6. Kort fortalt: Dyrkningen af mikroorganismerne kaldes fermentering. Der foretages gerne mange små forsøgs-fermenteringer for at finde de optimale forhold.
Kort, fiktivt eksempel: Forskerne kan nu dyrke (fermentere) deres celler i små forsøgstanke for at producere vaskeenzymet. På den måde kan de eksperimentere med temperatur, pH, osv. for at optimere cellefabrikkens udbytte og hastighed
7. Oprensning til færdigt produkt
Når en fermentering er løbet til ende, høstes fermenteringsblandingen. En høstet fermenteringsblanding består af de tilbageværende næringssalte, celler og deres udskilte metabolitter. Under fermenteringen produceres produktet enten intracellulært (inden i cellerne) eller ekstracellulært, hvor de eksporteres ud af cellen. Derfor venter der efter fermenteringen en svær og vigtig udfordring med at sikre en høj andel af produktet i en acceptabel renhed.
Kravet til renhed er meget højt for medicinske stoffer, mens produkter til industriel brug typisk kan accepteres i lidt lavere renhed. Årsagen til, at det kan være fordelagtigt at acceptere en lavere renhed, skyldes, at en mindre del af produktet går tabt under oprensningen, når der stilles lavere renhedskrav. Desuden betyder små urenheder ikke altid så meget. I oprensning af enzymer kan fx 70 % gå tabt undervejs.
Design af en mikrobiologisk oprensningsproces kræver både kendskab til de biologiske og kemiske forhold for det aktuelle produkt og fermenteringsblanding. Processen er typisk sat sammen af en række trin, alt efter behov. Blandt de vigtige er filtrering, centrifugering og kromatografi.
Produktets renhed og kvalitet kan til sidst sikres ved test med kromatografisk udstyr.
Og hvad bliver der af alle cellerne (biomassen) efter fermenteringen? Hvis de slås ihjel med varmebehandling, kan de fx blive til gavn en sidste gang som næringsrigt gødning på markerne.
Hvis produktet består kvalitetstesten, er det nu klar til pakning og salg, såfremt det har myndighedernes godkendelse.
7. Kort fortalt: Når cellerne er færdige med at producere deres produkt, skal det værdifulde nye produkt oprenses fra alle celleresterne og de andre dannede stoffer. Herefter skal det kvalitetstestes inden salg.
Kort, fiktivt eksempel: Vaskeenzymet skal adskilles fra den høstede fermenteringsblanding. Oprensningsopgaven bliver desværre ekstra besværlig, fordi den valgte bakterie ikke eksporterede enzymet ud af cellen. Efter flere oprensninger er der ikke meget af enzymet tilbage, men heldigvis viser tests dog, at produktet er tilstrækkelig rent. Udviklerne får derfor besked af ledelsen på, at de godt kan skynde sig at optimere cellefabrikken til masseproduktion i store fermenteringstanke.
Især vigtigt at huske:
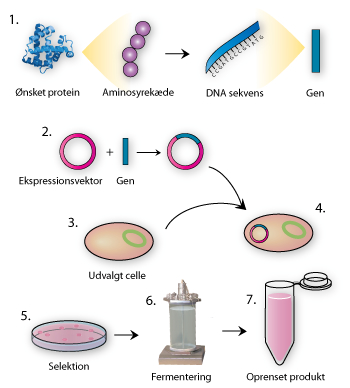
Cellefabrikker er celler, der fermenteres for at producere et interessant protein såsom insulin eller metabolitter såsom penicillin.
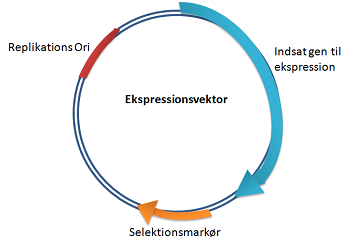
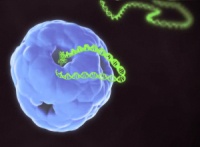
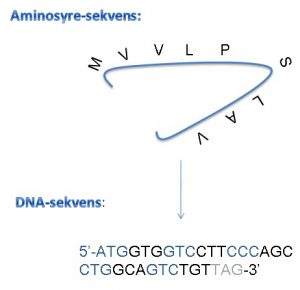
Cellefabrikkerne kan designes ved at gensplejse cellen med en ekspressionsvektor, der indeholder det proteinkodende DNA og de nødvendige genregulerende sekvenser.
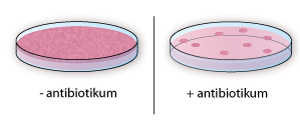
- Selektion kan bruges for at udvælge de rigtigt gensplejsede celler med fx antibiotikaresistens.
- Cellerne dyrkes ved fermentering, hvor de optimale produktionsforhold skabes mht. næring og temperatur m.m. Til sidst skal produktet oprenses fra alle de øvrige celledele.