Reguleringen af generne er utrolig vigtig for, hvordan cellerne bliver, men også fordi den også sikrer, at organismen sparer på ressourcerne ved kun at producere de proteiner, der er nødvendige.
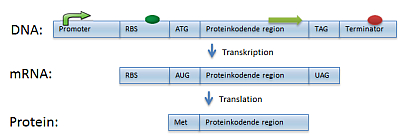
Som figur 19 viser, vil DNA’et for ét gen typisk indeholde mange flere elementer end blot den proteinkodende region. Også de omkringliggende elementer deltager i genreguleringen.
Promoter: Øgning af genets transkription
Når et protein fra et gen skal bruges i cellen, bliver transkriptionen af genets DNA aktiveret. Der dannes nu mRNA og dermed protein (forklaret i 1 Hvad er DNA og gener?). Kort inden den protein-kodende region af genet sidder der på DNA-strengen en bestemt sekvens kaldt en promoter, der netop har den opgave at hjælpe med at aktivere transkriptionen (figur 19). Gener, der altid bruges, har meget stærke promotere, som gør at generne altid er tændte og transkripteres. Omvendt findes promotere, der kun aktiveres i ganske særlige situationer, hvor genet er nødvendigt. Det kunne fx være, hvis cellen får et varmechok og skal beskytte sig. Genteknologien gør det muligt snedigt at udvælge lige den promoter, der passer godt til at aktivere det producerende gen i en bestemt cellefabrik.
Promoterens biologiske virkningsmekanisme
DNA’et der udgør en promoter, kan tiltrække helt særlige proteiner, der binder til promoteren. Disse proteiner kaldes transkriptionsfaktorer. Transkriptionsfaktorer kan være meget specialiserede til bestemte promoterer, hvor de kan binde til en helt speciel DNA- sekvens. Transkriptionsfaktorerne er kun til stede i cellen, når der er behov for transkription af de pågældende gener. Binding af disse transkriptionsfaktorer til promoteren på DNA’et er nemlig med til at guide enzymet RNA-polymerase til også at binde DNA’et, så det kan begynde at transkriptere DNA’et til mRNA. En sådan transkriptionfaktor kaldes også en aktivator.
I genetisk optimering af en cellefabrik er det som udgangspunkt smart at vælge en kraftig promoter, der fører til produktion af meget protein og dermed det ønskede produkt.
En promoter, der altid fører til transkription af DNA’et, kaldes konstitutiv. Men disse promotere er ikke altid de smarteste at anvende til at styre transkriptionen i en cellefabrik. Man kan nemlig ikke forhindre genet i at blive transkriperet hele tiden. Cellerne går straks i gang med at producere proteinet, selv mens de er i deres begyndende vækstfase, hvor ressourcerne måske hellere skal spares til først at skabe flere celler, inden selve produktionen af proteinet startes.
En anden promotertype kaldes inducibel, fordi bestemte forhold skal til for at starte transkriptionen. Det kan enten være fysiske betingelser (fx lav/høj temperatur) eller kemiske betingelser (fx tilstedeværelsen af et bestemt stof). En inducibel promoter kan derfor være smart at bruge med produktionsgenet i en cellefabrik. Det er især klogt, hvis produktet ligefrem har en giftig påvirkning af værtscellen. Med en inducibel promoter, kan man vente med at aktivere genet, til rigtig mange celler er vokset frem.
Terminator af transkription
Det kan være klogt at tilføje en terminator-sekvens lige efter genet, der koder for proteinproduktet (figur 19). En terminator sørger for at transkriptionen ophører, når RNA-polymerase når frem til den på sin vej hen ad DNA’et. Uden en terminator risikerer man også at få transkripteret så meget af den efterfølgende, irrelevante DNA-kode fra ekspressionsvektoren, at det forstyrrer cellen. Det ekstra mRNA som følger med kan også gøre mRNA’et meget ustabilt og letnedbrydeligt.
Ribosombindingssted (RBS) hjælper med genets translation
Translationen af mRNA til protein kan også øges genetisk. Inden selve den protein-kodende sekvens på mRNA’et (dvs. inden startcodonet) sidder der nemlig en sekvens, der er et ribosombindingssted (RBS) (figur 19). Der er forskel på typerne mellem eukaryoter og prokaryoter, men fælles er, at ribosomet her bindes inden, det bevæger sig hen til startcodonet og begynder selve proteinsyntesen. Ved at vælge bestemte RBS’er kan det lade sig gøre at opnå en bedre ribosombinding og dermed bedre translation af mRNA’et til protein.
Start- og stopcodon
Det første codon, der translateres til et protein, er altid startcodonet med mRNA-koden AUG. AUG koder for aminosyren methionin (T i DNA erstattes som bekendt af U i mRNA). I princippet begynder alle proteiner derfor med methionin. Tre af de 64 forskellige codons koder ikke for en aminosyre, men er i stedet stopcodons: DNA-koderne UAG, UGA og UAA får translationen af mRNA’et til at ophøre (figur 19).
Flere kopier af genet
Hvis et gen findes i flere kopier i cellen, øges også muligheden for at lave mere mRNA af det, og dermed øges også hvor meget protein der i sidste ende dannes. Når genet sidder i en ekspressionsvektor, afgøres genets antal kopier i cellen af den Ori-sekvens (Origin of replication), der er sat i vektoren. DNA-replikationen starter nemlig ved Ori, og der findes både stærke og svage af disse sekvenser. Nogle Ori-sekvenser giver fx kun én kopi af ekspressionsvektoren i cellen, mens andre stærke Ori kan give omkring 200 kopier i hver celle. Inden man så nu skynder sig at vælge den kraftigste Ori-sekvens, skal man være opmærksom på, at cellens vækst sænkes af at producere rigtig mange kopier, så produktionen måske slet ikke bliver større alligevel!
Optimering der ikke skyldes genregulering
Codon-optimering
Som nævnt koder flere forskellige codons i den genetiske kode for den samme aminosyre. Men det har vist sig, at nogle organismer foretrækker bestemte codons. Fx koder AAT og AAC begge for aminosyren asparagin, og hele seks forskellige codons koder for arginin (figur 19). Men én organismes gener vil typisk kun bruge nogle bestemte codons for hver aminosyre, idet hvert codon kræver én slags tRNA, og tRNA’et har forskellig udbredelse i de forskellige organismer. Der er udviklet små computerprogrammer, der kan lave optimeringen af det DNA, der skal bruges. DNA’et kunne fx stamme fra et pattedyr med væsentligt anderledes codon-brug end den bakterie- eller gærcelle, der skal bruges i cellefabrikken.