Proteinstruktur
Proteiner er polypeptider (poly = mange), som er sammensat af aminosyrer, der er bundet kovalent sammen gennem peptidbindinger (se infoboks 1).


Proteiner er polypeptider (poly = mange), som er sammensat af aminosyrer, der er bundet kovalent sammen gennem peptidbindinger (se infoboks 1).
Aminosyrer
Den generelle grundstruktur for en aminosyre kan ses i figur 5.
Der findes i alt 20 forskellige standardaminosyrer, der hver er karakteriseret på baggrund af deres sidekæde. Sidekæden definerer, hvilke kemiske egenskaber aminosyren har og dermed hvilke bindinger, den kan lave. De 20 aminosyrer er inddelt i fem kategorier på baggrund af deres kemiske egenskaber. Aminosyreopdelingen kan ses i tabel 1.
Primærstruktur
Aminosyrer bliver sat sammen gennem peptidbindinger, hvorved lange rækker af aminosyrer kan dannes. Som nævnt ovenfor kaldes disse rækker polypeptider. Peptidbindingen bliver dannet ved, at det negativt ladede oxygenatom i carboxylgruppen reagerer med et af hydrogenatomerne fra aminogruppen i en anden aminosyre.
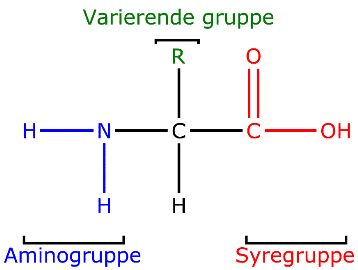
Figur 5. Den generelle struktur af en aminosyre. Den består af et carbonatom bundet til en positivt ladet aminogruppe, en negativt ladet carboxylgruppe, et hydrogenatom og en sidekæde.
Ved reaktionen bliver der afgivet et vandmolekyle (reaktionen er en kondensation), og en peptidbinding er dermed skabt, se figur 6.
Rækkefølgen af aminosyrerne i et protein betegnes et proteins primærstruktur. Polypeptider vil altid have to ender; en med en fri aminogruppe og en med en fri carboxylgruppe. Den ende i kæden, der har en fri aminogruppe, betegnes N-terminalen og den ende, der har en fri carboxylgruppe, betegnes C-terminalen.
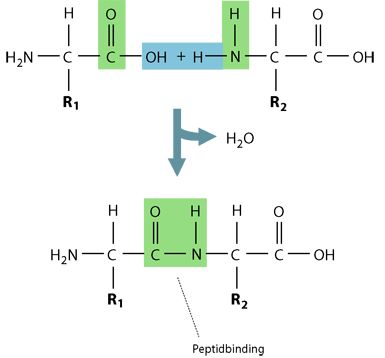
Figur 6. Danelsen af peptidbindinger. Det ses, at der frigives ét vandmolekyle for hver binding, der dannes.
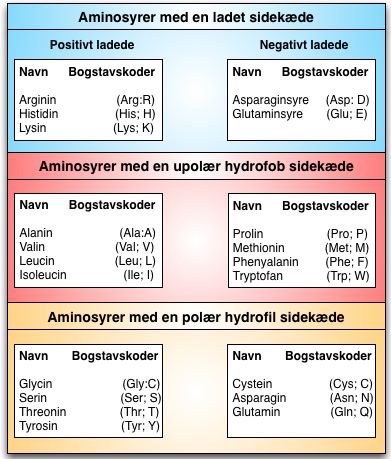
Tabel 1. Oversigt over de 20 forskellige aminosyrer, opdelt efter kemiske egenskaber.
Sekundærstruktur
De lange polypeptidkæder kan på grund af sidekædernes kemiske egenskaber foldes i lokale, rumlige strukturer. De mest udbredte strukturer kaldes α-helix og β-plader.
α-helixen er en spiral med en rygrad af aminosyrer, der er holdt sammen vha. hydrogenbindinger mellem hver femte aminosyre. Spiralen er konstrueret sådan, at aminosyrernes sidekæder stikker ud af spiralen. Sidekæderne kan interagere med hinanden for at skabe stabilitet til spiralen, men de kan også interagere med andre molekyler, se figur 7. α-helix’er er mest udbredt i membranproteiner (proteiner der går gennem cellemembranen) og i DNA-bindende proteiner. I DNA-bindende proteiner findes α-helixen i de domæner, der interagerer med DNA’et, så proteinet kan ændre på transkriptionen af DNA’et.
β-plader består af to eller flere β-strenge. β-strengene kaldes for β-plader backbones (rygrader) og er peptidkæder, der er sat sammen med hydrogenbindinger mellem hver backbone. β-pladernes struktur bevirker, at sidekæderne stikker vinkelret ud fra pladerne med en variation på hver anden, således at den første sidekæde stikker op ad, den anden stikker nedad, osv., se figur 8. β-plader bruges bl.a. til at danne strukturer, der går gennem cellemembranen, således at små molekyler kan transporteres ind og ud af cellen.
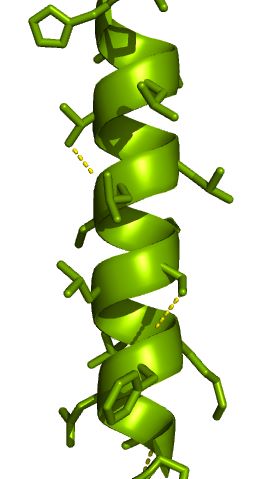
Figur 7. α-helix med sidekæder, hvor hydrogenbindinger er vist med gule prikkede linjer.
Tertiærstruktur
Polypeptidkæden er en dynamisk struktur, som på grund af de mange forskellige sidekæder kan foldes i forskellige strukturer. Disse strukturer danner proteinets tertiærstruktur, der ofte bliver stabiliseret af α-helix, β-plader, svovlbroer mellem aminosyren cysteins sidekæder samt hydrofobe/-file interaktioner mellem molekylerne. Proteiners tertiærstruktur bestemmer deres funktion. Foldningen bevirker nemlig, at aminosyrerne i proteinet bliver placeret, så de kan interagere i specifikke processer, f.eks. til at katalysere enzymatiske reaktioner.
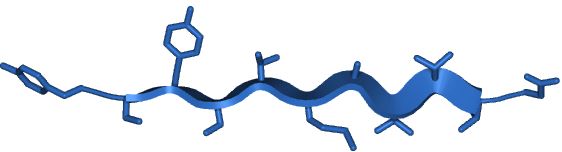
Figur 8. β-plade vist med sidekæder. Det kan ses, at sidekæderne er vinkelrette på pladen. Sidekæderne stikker skiftevis op og ned.
Proteiner kan være opdelt i såkaldte domæner, der hver folder uafhængigt af hinanden. Hvert domæne vil have en unik struktur og dermed forskellige egenskaber. I figur 9 er der givet et eksempel på en tertiærstruktur og i figur 10 et eksempel sammenhængen mellem et proteins primær-, sekundær- og tertiærstruktur.

Figur 9. Et proteins tertiærstruktur. Her kan både β-plader og α-helix ses.
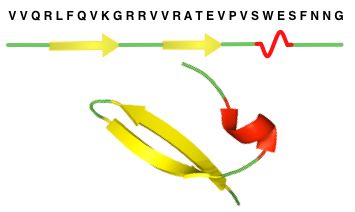
Figur 10. Sammenhæng mellem et proteins primær-, sekundær- og tertiærstruktur. β-plader er vist med gule pile. A-helix er vist med røde spiraler.
Kvaternærstruktur
De foldede polypeptidkæder kan interagere med hinanden og danne et proteinkompleks. Komplekset er proteinets kvaternærstruktur, og polypeptidkæderne betegnes som subunits i det færdige protein, se figur 11. Et proteinkompleks kan bestå af mange subunits, der både kan være forskellige og ens. Eksempelvis består et hæmoglobin-molekyle af fire identiske subunits, der hver kan binde et oxygenatom.
Konserverede domæner
Som nævnt ovenfor bliver polypeptidkæderne foldet til tertiærtrukturer, som har en specifik biologisk egenskab. En biologisk egenskab er f.eks. regulering af transkription (når et protein binder til DNA’et) eller nedbrydning af sukkermolekyler i fordøjelsessystemet.
Selvom det er hele proteinet, der har en biologisk egenskab, er det faktisk kun nogle bestemte aminosyrer eller længere peptidsekvenser i proteinet, der er direkte forbundet med funktionen. Den funktionelle del af proteinet er ofte konserveret (bevaret), dvs. den aminosyresammensætning, der er karakteristisk for en funktion, vil kunne findes på tværs af forskellige organismer, der ellers er fjernt beslægtede.
De aminosyrer, der ikke udgør den funktionelle del af et protein, er ikke så vigtige for proteinets funktion, men kan i stedet medvirke til at stabilisere protienstrukturen og -foldningen. Da aminosyrerne ikke indgår direkte i de biologiske funktioner, vil aminosyrerne til en vis grad kunne ændres eller fjernes uden at proteinet mister sine biologiske funktioner.
Figur 12 illustrerer, hvor konserverede domæner kan findes. Her er de konserverede domænerne i α-helixen og β-pladen (indikeret med en grå streg), mens de aminosyrer der er i loopet før, efter og mellem dem, er ændrede. Ændringerne har ikke betydning for sekundærstrukturen, og det er dermed den samme tertiærstruktur, der vil dannes fra begge sekvenser.
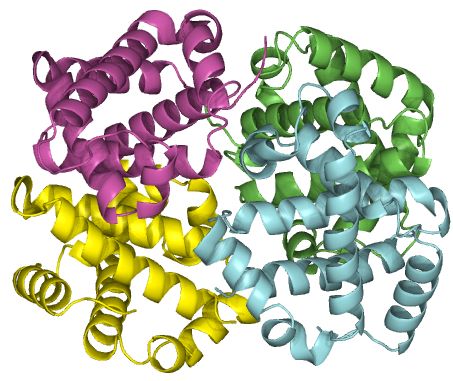
Figur 11. Et proteins kvaternærstruktur. Her er hæmoglobin vist, og de fire forskellige subunits kan ses med hver sin farve. Strukturen er fundet gennem PDB og lavet i PyMol.
Når man laver alignments vil man ofte kunne se konserverede domæner, dvs. aminosyrerne på disse positioner vil være identiske i de sekvenser, der sammenlignes. Endvidere vil aminosyrerne uden for domænet i højere grad variere, men ofte vil aminosyrerne være inden for samme kemiske gruppe som klassificeret i tabel 1. Når aminosyrerne er inden for samme gruppe, vil de have den samme kemiske egenskab og dermed bibeholde proteinet i en korrekt struktur.
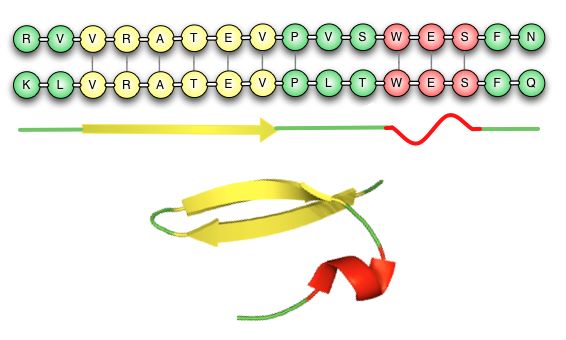
Figur 12. De konserverede domæner i De to viste poteinsekvenser har der hvor de danner en α-helix og en β-plade. Selvom den primærstruktur ikke er helt identisk mellem de to sekvenser, vil de alligevel have den sammen tertiærstruktur og dermed samme funktion.