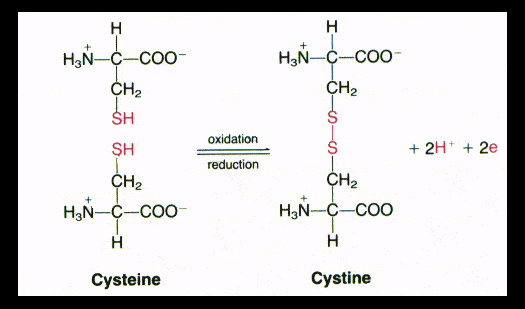
Figur 7. To cysteinenheder sammenkobles i en oxidationsreaktion, hvorved der dannes en disulfidbinding.
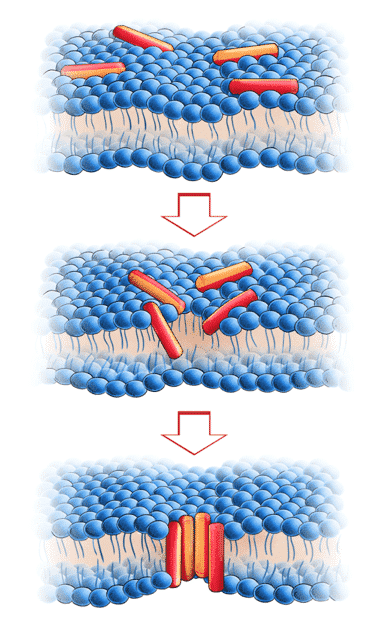
AMP’ers umiddelbare binding til cellemembraner sker gennem interaktioner mellem den kationiske del af AMP og den negativt ladede bakterielle cellemembran. Efter umiddelbar tiltrækning og binding af AMP’er til cellemembranen ophobes de for at kunne udøve deres effekt. Når der kun er få AMP’er til stede befinder de sig parallelt med cellemembranens overflade, og det ser ud som AMP’erne ligger på cellemembranen. Efterhånden som der tiltrækkes flere peptider til cellens overflade, vil de begynde at bore sig ned i cellemembranen. Peptiderne binder sig sammen og danner en transmembran (membrangennemborende) kanal. På denne måde skaber peptiderne et hul i cellemembranen. AMP’erne sætter sig sammen således, at peptidernes hydrofobe side vender ud mod cellemembranens hydrofobe fedtsyrer, mens deres hydrofile side vender ind mod de andre peptiders hydrofile side. Når der er et hul i cellemembranen kan hydrofile (polære) stoffer og ioner, der ellers ikke ville kunne passere cellemembranen, nu bevæge sig frit frem og tilbage gennem hullet, hvorved cellen dør.
Som det fremgår af ovenstående, er den hydrofobe del af AMP’er vigtig i ødelæggelsen af bakterielle cellemembraner. Dog kan det være et problem, hvis der er for mange hydrofobe aminosyrer i dem, da specificiteten over for bakterielle cellemembraner mindskes. Dette skyldes, at de hydrofobe regioner på peptidet tiltrækkes af hydrofobe regioner på eukaryote cellemembraner. Herved kan man risikere, at cellemembranerne hos de eukaryote celler vil blive ødelagt sammen med eller i stedet for de prokaryote cellemembraner hos bakterierne. Hvis de antimikrobielle peptider har denne effekt på humane celler, siges de at være toksiske over for mennesker. De fleste AMP’er i naturen er ikke hydrofobe nok til at udvise denne toksicitet over for mennesker og udviser kun eller næsten kun toksicitet over for bakterier.
Hvordan kan vi bruge antimikrobielle peptider som lægemidler? Det er vigtigt at forstå de molekylære mekanismer bag AMP’ers antibakterielle effekt for at kunne designe syntetiske AMP’er og derved bruge dem som lægemidler. Selvom der stadig er uklarhed omkring AMP’ers præcise virkningsmekanismer, hersker der ingen tvivl om, at en del af AMP’ers antibakterielle effekt ligger i deres interaktion med cellemembraner. Derudover har mange AMP’er vist sig at virke hæmmende på cellevægssyntese og celledeling, idet nogle AMP’er kan bevæge sig ind i cellen og påvirke intracellulære processer. Et eksempel på en AMP, der virker hæmmende på cellevægssyntesen er Plectasin.
Den stigende forekomst af resistente bakterier er hovedårsagen til vores interesse for AMP’er. Mange forsøg med AMP’er tyder på, at de kan være fordelagtige at anvende som antimikrobielle lægemidler i stedet for konventionelle antibiotika. Da AMP’er er specifikke over for en så fundamental del af cellen som dennes membran, er sandsynligheden for, at der udvikles resistens, minimal. Det ville kræve meget af bakterien, hvis den skulle til at ændre sin cellemembran og udvikle en resistensmekanisme til at bekæmpe AMP’ers membranødelæggende effekt. Derudover gør AMP’ers mange virkningsmekanismer det svært for mikroorganismer at blive resistente over for dem. Grunden til dette er, at hvis der forekommer en mutation i ét af AMP’ernes ’targets’, vil der stadig være andre processer, som AMP’er kan gå ind og ødelægge, hvilket forhindrer bakterien i at vokse. Idet de fleste AMP’ers primære virkningsmekanisme er gennemhulning af cellemembranen, siger man, at AMP’er er bakteriocidale frem for bakteriostatiske. På grund af deres amphipatiske natur binder de sig desuden effektivt til den bakterielle cellemembran, som hos både Gram-positive og Gram-negative bakterier er negativt ladet. Dog skal det nævnes, at forskellige AMP’er kan have meget forskellig aktivitet over for de to typer af bakterier. Nogle AMP’er udviser kun en effekt på Gram-positive bakterier, nogle udviser kun en effekt på Gram-negative bakterier og andre har en effekt på både Gram-positive bakterier og Gram-negative bakterier. I mange af de forsøg, der er blevet lavet med diverse AMP’er, viser det sig, at der ikke skal tilsættes særlig meget af peptidet for at dræbe bakterierne. Man siger, at AMP’er har en lav ”Minimal Bacteriocidal Concentration” (MBC).
Det tyder på, at AMP’er er de perfekte lægemidler, men hvorfor er de så ikke på markedet endnu? Processen, man skal igennem fra opdagelsen af et stof, der har potentiale til at blive et godt lægemiddel, til produktionen og indførelsen af dette på markedet, er mildt sagt lang og sej. Et potentielt lægemiddel skal igennem en lang række forsøg i laboratoriet før det må testes på mennesker i kliniske studier. Lægemiddeludviklingsprocessen er tidskrævende og dyr, og det tager i gennemsnit 14 år og koster 3 milliarder kroner at få et lægemiddel på markedet. Der forekommer mange forhindringer på vejen mod design af AMP’er som lægemidler, men den stigende forekomst af resistente bakterier skal bekæmpes på en eller anden måde. Flere AMP’er har også vist sig at være meget lovende.
Hvordan opdager man lægemidler ved en tilfældighed? Hele vores antibiotikahistorie startede med en tilfældig opdagelse, nemlig opdagelsen af penicillin. Det har siden hen ikke været en sjældenhed, at potentielle lægemidler er blevet opdaget ved en tilfældighed. I 2002 undersøgte en forsker fra Novozymes den lille sorte svamp Pseudoplectania Nigrella, idet han var på udkig efter enzymer med signalsekvenser, der transporterer enzymerne ud af cellen. Han benyttede sig af computerbaserede metoder til at undersøge gensekvenserne, han fandt fra svampen, og faldt pludselig over en lille DNA-sekvens, der i høj grad mindede om humane defensiner. Kunne dette være et AMP? Ja, det viste sig netop at være tilfældet. Det var ikke alene et AMP, det var tilmed et effektivt ét af slagsen. Forskeren lavede senere en undersøgelse af en sandorm, idet målet endnu engang var at finde enzymer, der nu skulle kunne bruges i vaskemiddel. Her blev det lille cystein-stabiliserede β-sheet AMP Arenicin 3 fundet, som viste sig at have en utrolig effekt på Gram-negative bakterier. Arenicin 3 har fået sit navn, fordi der tidligere er blevet fundet to AMP’er, Arenicin 1 og Arenicin 2, som det strukturelt set ligner meget. Disse to AMP’er havde vist sig at have en effekt på både Gram-positive og Gram-negative bakterier.
Er antimikrobielle peptider så fremtidens antibiotika? Dette spørgsmål kan du måske være med til at svare på? Forskningen inden for AMP’er er stadig en åben bog, og vi kan ikke gøre andet end at læse videre. Man vil selvfølgelig gerne sætte en stopper for den stigende fremkomst af resistente bakterier, men er det muligt at designe og producere tilstrækkelige antibiotika til at stoppe fremkomsten? Hvis resistensudvikling skal begrænses, kræver det, at man er restriktiv med brugen af antibiotika. Lægerne må kun udskrive recepter på antibiotika, når de er sikre på, at der er tale om en bakterieinfektion, og det er vigtigt, at man som patient nøje følger lægens vejledning og ikke stopper antibiotikabehandlingen for tidligt.