Lægemiddeludvikling og antimikrobielle peptider


Grundet den stigende forekomst af resistente bakterier, er der i de seneste år kommet fokus på, hvorvidt antimikrobielle peptider (AMP’er) kan benyttes som nye antibiotika. Meget tid og mange penge er dog krævet for at få et nyt antibiotikum på markedet. Lægemidler skal godkendes, før de må sælges. I Danmark skal medicinalvirksomheden ansøge enten Sundhedsstyrelsen eller EU om godkendelse af lægemidlet, før det må sendes på markedet. Der stilles mange strenge krav, som et potentielt antibiotisk stof skal kunne opfylde. Udviklingen af nye antibiotika og andre lægemidler er derved en lang og sej proces (Figur 20).
Hvis et lægemiddel med succes kommer igennem de prækliniske studier, skal det efterfølgende igennem flere forskellige kliniske studier med mennesker, før det kan godkendes som værende tilfredsstillende nok til at komme på markedet. Statistisk set vil der, ud af de 10.000 molekyler, der viser sig at have potentiale i lægemiddeldesignfasen (Figur 20), være ca. 500, der er sikre nok til at fortsætte til prækliniske studier, hvor de testes på dyr. Heraf vil omkring 10 molekyler nå de første kliniske studier udført med mennesker og kun 1 ud af de oprindelige 10.000 molekyler vil i sidste ende komme på markedet, som et godkendt lægemiddel. Det tager i gennemsnit 14 år og 3 milliarder kroner at få et lægemiddel på markedet.
Undervejs i processen vil der uden tvivl opstå problemer, idet lægemidlet skal opfylde utallige krav, før det kan sendes ud på markedet. Lægemidlet skal have den ønskede effekt og kun virke et specifikt sted i kroppen uden at forsage problemer andre steder.
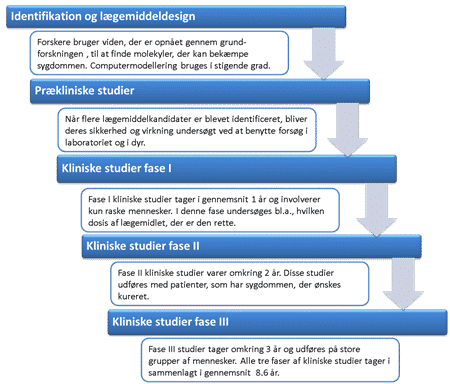
Figur 20. Figuren viser lægemiddeludviklingsprocessen fra opdagelsen af lovende molekyler til de sidste stadier i de kliniske studier med mennesker.
Hvis lægemidlet ikke udelukkende virker det ønskede sted, kan det være toksisk (giftigt) for kroppen, hvorved der kan forekomme bivirkninger ved indtag af stoffet. Ved udvikling af et nyt lægemiddel fokuseres der derfor først og fremmest på interaktionerne mellem lægemidlet og det område i kroppen, hvor lægemidlet skal udøve sin effekt, samt om lægemidlet i det hele taget når frem til det ønskede område. Dette specifikke område, hvortil lægemidlet skal nå hen og binde sig kaldes et ’target’.
Under udviklingen af lægemidler vælges først hvilken sygdom, der ønskes bekæmpet, og derved hvilket ’target’, som lægemidlet skal angribe. Det er dernæst vigtigt at finde et stof, der kan binde sig til det ønskede target og udøve sin effekt uden at have bivirkninger. ’Target’ for AMP’er er, ligesom for traditionelle antibiotika, bakteriecellen. Det varierer dog meget, hvordan forskellige AMP’er udøver deres effekt på bakterien. AMP’er tiltrækkes bakteriecellen grundet ladningsforskelle, idet AMP’er er kationiske, mens bakteriecellens overflade er anionisk, hvorefter de fleste AMP’er borer sig ned cellemembranen og laver huller. Cellemembranen bliver derved permeabel (gennemtrængelig) for livsvigtige molekyler, der siver ud, hvilket resulterer i øjeblikkelig celledød.
Når vi har udvalgt et kemisk stof, som vi er interesseret i at teste, kan vi begynde at udføre forskellige forsøg. Før vi kan teste et potentielt lægemiddel på mennesker, skal det igennem en række prækliniske studier. Først udføres in vitro studier med det potentielle lægemiddel for at undersøge, om det virker på det ønskede ’target’. Dernæst benyttes in vivoeksperimenter til at undersøge, om stoffet kan nå det ønskede ’target’ uden at blive nedbrudt undervejs. Hvis lægemidlet skal kunne indtages oralt, skal det igennem flere forhindringer på sin vej til sit mål. Det skal kunne modstå nedbrydning af diverse enzymer i tarmen, kunne absorberes henover tarmvæggen, komme igennem leveren uden at blive nedbrudt for meget og transporteres i blodbanen uden at blive nedbrudt for hurtigt (Figur 20).
Et AMP, der tænkes at være et potentielt lægemiddel, skal igennem diverse eksperimenter, før det kan godkendes til at blive testet i kliniske studier.
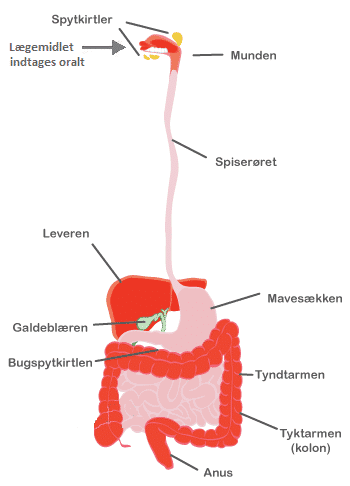
Figur 21. Når et lægemiddel indtages oralt, skal det igennem flere forhindringer på sin vej til at nå sit ’target’.
AMP’et skal testes på specifikke bakteriekulturer for at undersøge om det har en effekt på Gram-positive bakterier, Gram-negative bakterier eller begge. AMP’et skal være stabilt under fysiologiske betingelser og undgå at blive nedbrudt for hurtigt. Det skal testes, om AMP’et forbliver aktivt, når det kommer ind i blodbanen, dvs. om det er salttolerant. Det skal være proteasestabilt, hvilket betyder, at det ikke må nedbrydes af proteaser i kroppen. Proteaser er enzymer, der nedbryder proteiner. Derudover må dets effekt ikke hæmmes af kationer (positivt ladede ioner).
Effektiviteten af det potentielle antibiotikum testes ved at undersøge, hvor stor en antibiotikakoncentration der skal til for at dræbe de tilstedeværende bakterier. Denne dosis antibiotikum kaldes den effektive dosis. Det skal også testes, hvor stor en koncentration der skal til for at dræbe røde blodlegemer, hvilket kaldes den toksiske dosis. Forholdet mellem den toksiske dosis og den effektive dosis betegnes det terapeutiske indeks.
Ideelt set skal der være stor forskel på den effektive dosis og den toksiske dosis, idet der helst kun skal en lille mængde antibiotikum til for at have en helbredende effekt, mens en meget større dosis kræves for at have en toksisk effekt på kroppen, dvs effektiv dosis < toksisk dosis. Når det terapeutiske indeks er blevet bestemt, skal der udføres forsøg, det tester, hvor længe AMP’et bliver i kroppen, dvs. hvor lang tid der går, før det er blevet nedbrudt. AMP’et skal blive længe nok i kroppen til at udøve sin effekt, men ikke så længe, at det har en toksisk effekt på kroppen. Da AMP’ers primære virkningsmekanisme er at lave huller i cellemembranen, kan det bestemmes i hvilken grad, det testede AMP laver disse huller og ødelægger cellemembranen. Dette kan måles ud fra hvor meget intracellulært indhold, der frigives fra bakterien til det ekstracellulære miljø. Udover de forskellige forsøg der skal udføres, skal der også tages højde for, hvad det koster at producere det potentielle lægemiddel i store mængder. En ulempe ved AMP’er er, at de generelt er dyre og teknisk svære at fremstille.
AMP’er har oftest en virkelig god bakteriedræbende effekt, men mange peptider er toksiske, idet de angriber humane celler såvel som bakterieceller, eller de forbliver ikke længe i kroppen, da de nedbrydes af proteaser. Mange AMP’er, som umiddelbart virker som lovende lægemidler, når derved ikke til de kliniske studier.
Lægemidlet vil nå til de kliniske studier, hvis stoffet har vist sig at have den ønskede effekt under dyreforsøg, viser sig at være bedre end andre lignende stoffer på markedet, kan klare ”rejsen” gennem kroppen uden at live nedbrudt undervejs, har få stofskifteprodukter, har en rimelig halveringstid og ingen alvorlige bivirkninger. De kliniske studier tager 5-7 år at udføre, involverer flere tusinde patienter og kan være meget dyre. De kliniske studier er opdelt i flere faser. Fase I studier forløber over ca. et år og involverer kun raske mennesker. Disse studier undersøger, hvordan stoffet metaboliseres i mennesker, og hvor biotilgængeligt det er. Fase II studier varer omkring to år og udføres med patienter, som har sygdommen, der ønskes kureret, mens fase III studier tager omkring 3 år og udføres med store grupper af patienter. På denne måde vil bivirkninger, der måske ikke er blevet bemærket i studier med mindre grupper af mennesker, evt. observeres i fase III studierne. Stoffer der testes, sammenlignes i høj grad med lægemidler, der allerede er på markedet. Dette gøres for at sikre, at man har at gøre med et stof, der adskiller sig tilstrækkeligt fra andre lægemidler på markedet.
Antallet af AMP’er, der kommer igennem de prækliniske studier med succes, er begrænset. Dette skyldes, at mange naturligt forekomne AMP’er enten helt eller delvist mister deres antibakterielle effekt under fysiologiske betingelser, dvs. i et miljø, der ligner det i menneskekroppen. Et antimikrobielt peptid kan virke meget lovende, når det testes på bakterier alene, men hvis det viser sig at miste sin antibakterielle effekt, så snart det kommer ind i kroppen, vil det øjeblikkeligt blive afvist som potentielt lægemiddel. AMP’er er generelt meget pH- og saltfølsomme. De mister derved deres aktivitet, når saltkoncentrationen bliver for høj, og mange AMP’er mister deres aktivitet, når de kommer ind i blodet. Da AMP’er er små proteiner, kan de desuden risikere at blive nedbrudt af proteaser, hvorved de ikke forbliver i kroppen længe nok til at udøve deres effekt. Derudover binder nogle AMP’er sig til plasmaproteiner, som er proteiner, der befinder sig i blodet. Når AMP’erne er bundet til plasmaproteiner, vil de være forhindret i at binde sig til bakterielle cellemembraner. Flere naturligt forekomne AMP’er desuden er blevet associeret med toksicitet og udviser lav biotilgængelighed og lav metabolisk stabilitet, dvs. de nedbrydes hurtigt, når de kommer ind i kroppen. Toksiciteten af AMP’er kan dog mindskes ved at modificere dem syntetisk i laboratoriet. Når nye AMP’er skal designes, tages der udgangspunkt i naturlige AMP’er, hvis aktivitet er kendt. På denne måde kan man forbedre den antimikrobielle aktivitet og reducere toksiciteten ved at ændre en smule i aminosyresammensætningen.
Aktuelt, bliver flere modificerede varianter af naturligt forekomne AMP’er testet i kliniske studier. De fleste af disse må dog bruges som cremer og påføres på selve infektionsstedet. Dette skyldes, at AMP’er, som nævnt, hurtigt bliver nedbrudt i kroppen, når de indtages oralt, idet de skal igennem mange forhindringer på vejen til deres ’target’. Da flere AMP’er nu er kvalificerede til fase II og fase III kliniske studier, kunne AMP’er godt tyde på at have potentiale til at være fremtidens antibiotika.