I forhold til AMP’er er det den hydrofile del af cellemembranen, der er interessant at se nærmere på. Dette skyldes, at det er den hydrofile del af lipiderne, der vender ud mod omgivelserne, og det er derved denne del af cellemembranen, som AMP’er skal vekselvirke med. Den hydrofile del er afgørende for, om AMP’er virker på bakterier eller mennesker.
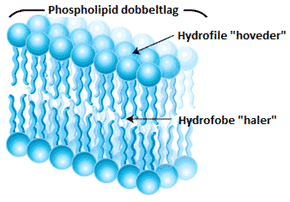
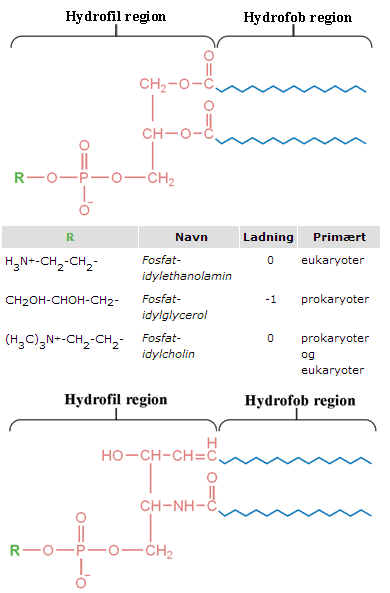
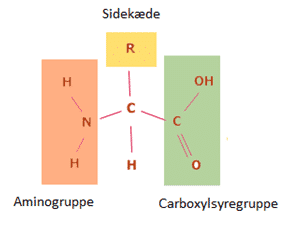
Den mest grundlæggende egenskab af lipiderne, der findes i cellemembranen, er, at de er amfifile. Den hydrofobe del kan have varierende længde og bestå af et varierende antal dobbeltbindinger. Den hydrofile del indeholder ladede grupper, f.eks. fosfat (PO4–), som er negativt ladet, eller ammoniak (NH3+), som er positivt ladet. Cellemembraner vil have forskellige overordnede ladninger alt afhængigt af antallet af positivt og negativt ladede grupper. Hvis der eksempelvis kun er en negativ fosfatgruppe i de lipider, der opbygger en given membran, vil membranen være negativ. Hvis der derimod både er en fosfatgruppe (-1 i ladning) og en ammoniakgruppe (+1 i ladning) i lipiderne, vil membranen være neutralt ladet. Lipider, der både indeholder en positivt ladet gruppe og en negativt ladet gruppe, men har en samlet ladning på 0 (neutrale lipider), kaldes zwitterioniske lipider.
Den mest udbredte gruppe af membranlipider indeholder en fosfation i det hydrofile hoved, enten alene eller sammen med en anden ion. Denne gruppe af lipider kaldes fosfolipider. Fosfolipiderne ses i en dobbeltlagsstruktur i figur 8 og deres generelle struktur, samt eksempler på forskellige slags fosfolipider, er vist i figur 9.
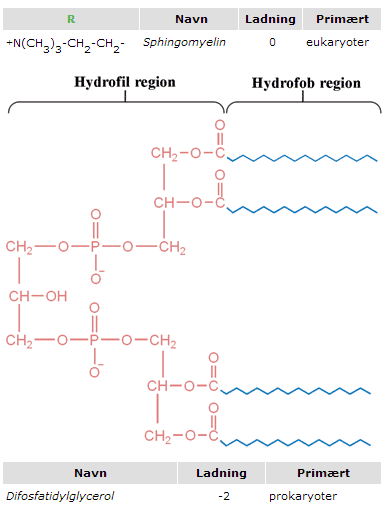
Diversiteten i lipidernes opbygning er afgørende for, om AMP’er virker på en given organisme. De lipider, der findes i den prokaryote membran, er primært negativt ladede, mens de der findes i den eukaryote membran ofte er neutralt ladet (Figur 9). Det skal understreges, at der hos begge celletyper findes et væld af andre lipider, men de i figur 9 nævnte udgør størstedelen af membranernes lipidindhold og er derfor bestemmende for membranens ladning.
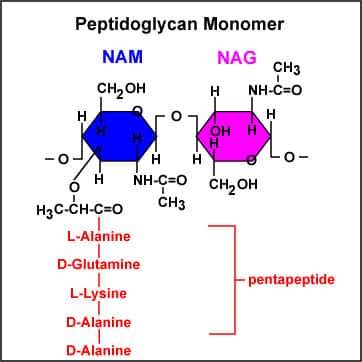
Udover cellemembranen har bakterieceller en cellevæg, der ikke ses hos humane celler. Bakteriers cellevæg består af molekylet peptidoglykan (figur 10). Cellevæggen hos Gram-positive mikroorganismer består af et relativt tykt lag peptidoglykan, hvori der sidder teichoidsyrer, som er negativt ladede. Hos Gram-negative bakterier er cellevæggen noget tyndere, men uden på denne sidder en ekstra membran; den ydre cellemembran. I den ydre cellemembran findes lipopolysaccharid (LPS), der også har en negativ ladning. Heraf ses, at cellevæggen hos både Gram-positive og Gram-negative bakterier repræsenterer en negativ overflade.
Da AMP’er er kationiske, vil de tiltrækkes celleoverflader, der er negativt ladede. AMP’er vil derfor foretrække at binde til en negativt ladet bakterieoverflade frem for en human celleoverflade.
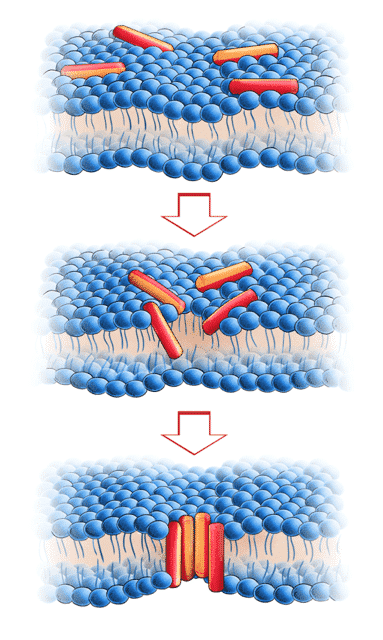
Når kationiske AMP’er nærmer sig cellens overflade og kommer i kontakt med den cytoplasmiske cellemembran, vil de interagere med de negativt ladede “hoveder” på fosfolipiderne. For at AMP’erne kan bore sig ned i cellemembranen og sætte sig dér, skal AMP’erne have en amfifil struktur, hvorved den hydrofile del kan interagere med fosfolipidernes ”hoveder” og de andre AMP’ers hydrofile del, mens den hydrofobe del interagerer med fosfolipidernes ”haler” i den indre del af cellemembranen (se figur 11). På grund af AMP’ers struktur og indhold af hydrofobe aminosyrer kan de indsætte sig i både eukaryote og prokaryote cellemembraner, men idet eukaryote membraner primært består af zwitterioniske lipider med en nettoladning på 0, og prokaryote membraner består af negativt ladede lipider, vil AMP’er tiltrækkes bakterielle cellemembraner i højere grad end humane cellemembraner.