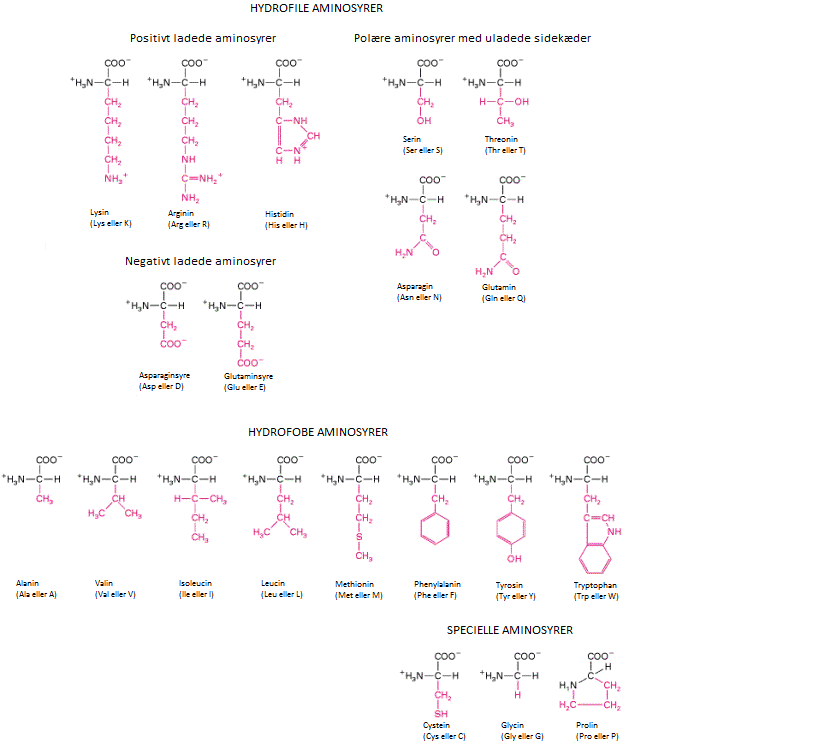
Proteinstruktur og de 20 aminosyrer


Antimikrobielle peptider (AMP’er) er små proteiner, der er i stand til at dræbe mikroorganismer. AMP’er hører derved under proteiner, gruppen af de mest alsidige makromolekyler i vores krop, som har essentielle funktioner i de fleste biologiske processer. For at forstå hvordan antimikrobielle peptider ser ud, og hvordan de er struktureret, når de angriber en bakteriecelle, skal vi se nærmere på opbygningen af proteiner generelt.
Proteiner er lineære polymerer bestående af enkelte monomerer kaldet aminosyrer, der er bundet sammen. Proteiner forbliver ikke lineære, men folder sig spontant sammen og danner en tredimensionel struktur, der er bestemt af den specifikke aminosyresekvens, dvs. sammensætning af de enkelte aminosyrer. Størrelsen af forskellige proteiner varierer meget, idet nogle kun er få aminosyrer lange, hvor bl.a. hormonet insulin, bestående af 51 aminosyrer, kan nævnes som eksempel, mens andre udgøres af flere tusinde aminosyrer, som eksempelvis muskelproteinet titin. Titin er det største protein man kender til, idet det består af over 27.000 aminosyrer.
Aminosyrer er byggestenene i proteiner, og den specifikke aminosyresekvens i et protein betegnes dets primære struktur. En aminosyre består af et centralt carbonatom, som er bundet til en aminogruppe, NH2, en carboxylsyregruppe, COOH, et hydrogenatom og en sidekæde, der kaldes R-gruppen (se figur 23).
Der findes i alt 20 forskellige sidekæder, som varierer i størrelse, ladning, hydrofob karakter og kemisk reaktivitet.
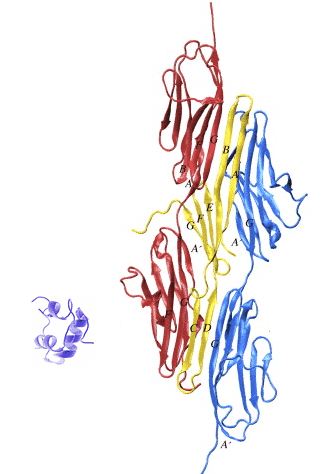
Figur 22. Proteinet insulin ses til venstre og sidestilles med muskelproteinet titin, som er det største protein, man kender til.
I vandige opløsninger ved neutral pH-værdi er aminosyrer oftest zwitterioner, hvilket betyder at aminogruppen er protoneret (NH3+) og carboxylsyregruppen er deprotoneret (COO–). Hvorvidt aminosyrer er ioniseret eller ikke er ioniseret afhænger af pH-værdien (se figur 24).
Proteiner dannes ved sammenkædning af aminosyrer. Aminosyrer sammenkædes via en kemisk reaktion mellem aminogruppen på én aminosyre og carboxylsyregruppen på en anden. Herved dannes en peptidbinding mellem de to aminosyrer. Reaktionen kaldes en kondensationsreaktion, da der fraspaltes vand (se figur 25). Flere aminosyrer, der er kædet sammen via peptidbindinger, danner en polypeptid kæde. De fleste polypeptid kæder består af mellem 50 og 2000 aminosyrer og betegnes proteiner. Kæder, der består af færre end 50 aminosyrer, betegnes peptider.
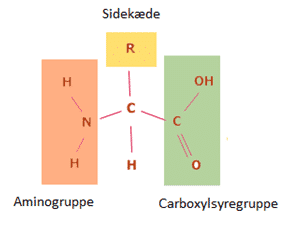
Figur 23. Den kemiske struktur af aminosyrer. Fire kemiske grupper er bundet til det centrale carbon-atom. Sidekæden ’R’ varierer i de 20 forskellige aminosyrer, og det er derfor denne gruppe, der giver aminosyren sine specifikke karakteristika.
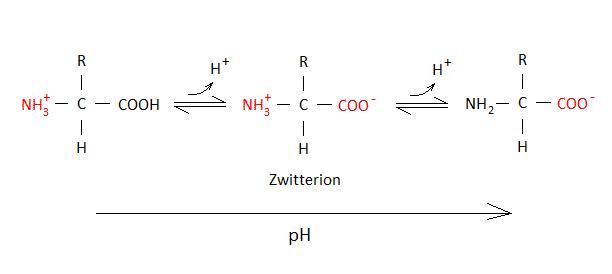
Figur 24. Ved pH omkring 7 befinder aminosyrer sig hovedsageligt på en zwitterionisk form, hvor aminogruppen er protoneret og har derved en positiv ladning, mens carboxylgruppen er deprotoneret og har derved en negativ ladning.
Antimikrobielle peptider er oftest under 50 aminosyrer lange, hvorfor de netop betegnes peptider. AMP’er er en gruppe molekyler, der strukturelt set er ret forskellige, da aminosyresekvensen varierer meget fra AMP til AMP. De karakteriseres dog ved at have en netto positiv ladning, dvs. de er kationiske, grundet tilstedeværelsen af positivt ladede aminosyrer. Derudover er en stor bestanddel (over 30 %) af aminosyrerne, der udgør peptiderne, hydrofobiske.
Grundet den store variation i aminosyresekvensen, kan AMP’er ikke karakteriseres på baggrund af deres primærstruktur, men karakteriseres i stedet på baggrund af deres sekundærstruktur. AMP’er kan strukturelt set inddeles som værende:
– α-helix AMP’er
– cystein-stabiliserede β-sheet AMP’er
– AMP’er rige på specifikke aminosyrer
De cystein-stabiliserede β-sheet AMP’er indeholder en eller flere specielle krydsbindinger, der også ses i mange andre proteiner. Denne krydsbinding kaldes en disulfidbinding og er den mest almindeligt forekomne i proteiner. Denne dannes ved, at to cysteinenheder reagerer med hinanden og danner forbindelsen cystin (se figur 26). Disulfidbindingen er med til at stabilisere mange proteiner og er derfor et vigtigt strukturelement i nogle AMP’er.
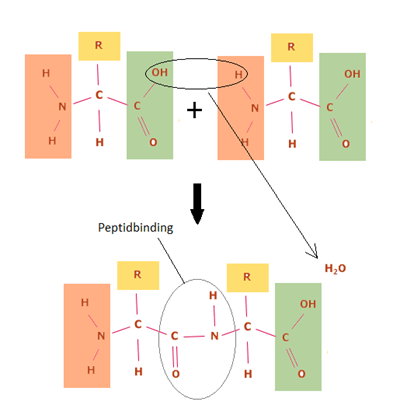
Figur 25. To aminosyrer sammenkobles i en kondensationsreaktion ved fraspaltning af vand, hvorved der dannes en peptidbinding mellem dem
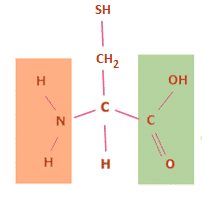
Figur 26. Aminosyren cystein er vigtig, da dens svovlatom medfører, at den har specifikke egenskaber. To cysteinenheder kan reagere og danne cystin, hvilket ses på figur 27.
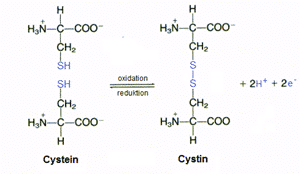
Figur 27. To cysteinenheder sammenkobles i en oxidationsreaktion, hvorved der dannes en disulfidbinding.
Proteiners sekundærstruktur er defineret som den lokale rumlige struktur af polypeptidkæden. Primærstrukturen, altså aminosyresekvensen, kan således resultere i mange områder med forskellige sekundærstrukturer. Sekundærstrukturen bestemmes af hydrogenbindinger mellem aminosyrerne i primærstrukturen. De to bedst definerede sekundærstrukturer er α-helixer og β-sheets. α-helixen er formet som en spiral, som aminosyrernes sidegrupper stikker ud fra (se figur 28). Spiralen drejer højre om, og der er 3,6 aminosyrer pr. omdrejning. Helixen holdes sammen af hydrogenbindinger mellem hver femte aminosyre. Strukturen kan stabiliseres yderligere af vekselvirkninger mellem sidegrupperne. Eksempeltvis kan hydrofobe vekselvirkninger, hvor sidegrupper, der er hydrofobe og derfor afskyr vand, tiltrækkes af hinanden, eller ionbindinger mellem positivt og negativt ladede sidegrupper kan være med til at stabilisere strukturen.
I modsætning til α-helixers meget kompakte struktur er β-sheets udstrakte (se figur 29). β-sheets udgøres af en eller flere β-strenge og stabiliseres, ligesom α-helixer, af hydrogenbindinger. β-strenge, der ligger ved siden af hinanden i et β-sheet, kan forløbe i samme retning, hvorved de siges af være parallelle, eller i modsat retning, hvorved de siges at være anti-parallelle.
Både α-helixer og β-sheets er strukturelementer, der ses i AMP’er, som en del af deres sekundærstruktur. Af de naturligt forekomne AMP’er findes der flest α-helix peptider. α-helix peptiderne er oftest ustruktureret i vandig opløsning, men når de nærmer sig og begynder at interagere med bakterielle cellemembraner, vil peptiderne folde sig sammen i en amfifil alfa-helix, hvor den ene del af helixen hovedsageligt udgøres af hydrofobiske aminosyrer, mens den modsatte del udgøres af positivt ladede aminosyrer. α-helix peptiderne har ikke en konserveret aminosyresekvens, dvs. der er stor variation i sekvensen i de forskellige peptider. Der er dog stor lighed i måden, hvorpå peptiderne ordner sig og adskiller hydrofobe aminosyrer fra ladede aminosyrer, når de kommer i kontakt med bakteriers overflade. Denne strukturering er vigtig for peptidernes funktion, idet det er den positivt ladede del af AMP’et, der binder sig til bakteriens negativt ladede overflade. Efterhånden som der kommer flere peptider til cellens overflade, vil de begynde at bore sig ned i cellemembranen, hvorved de sammen danner en transmembran (membrangennemborende) kanal (se figur 30). Her er den hydrofobe del af AMP’et vigtig, idet denne del vender ind mod cellemembranen og interagerer med membranens hydrofobe fedtsyrer.
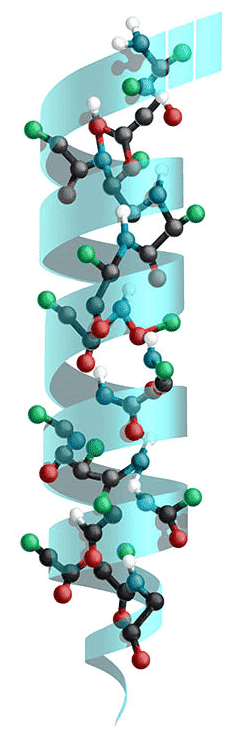
Figur 28. Alfa-helixen er formet som en spiral og har 3,6 aminosyrer pr. omdrejning.
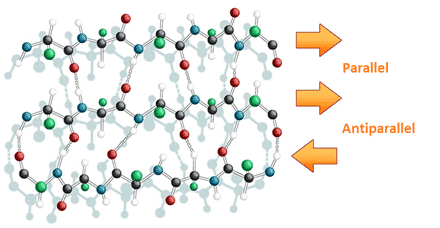
Figur 29. β-strenge, der ligger ved siden af hinanden i et β-sheet, kan enten være parallelle eller antiparallelle.
Udover primær- og sekundærstrukturen af proteiner har de en tertiærstruktur, der defineres som den rumlige struktur af et proteinmolekyles atomer uden hensynstagen til andre proteinmolekyler. α-helixer og β-sheets bidrager til tertiærstrukturen, idet visse dele af det samlede proteinmolekyle har disse strukturer. Interaktioner mellem de forskellige aminosyrer og deres sidekæder i polypeptidkæden har betydning for tertiærstrukturen. Tertiærstrukturen bestemmes ofte af hydrogenbindinger, interaktioner mellem hydrofobiske sidekæder, ionbindinger mellem positivt og negativt ladede sidekæder og af de tidligere omtalte disulfidbindinger mellem specielle cysteinsidekæder. For proteiner der befinder sig i vandige opløsninger, f.eks. cellens cytoplasma, vil det være naturligt, at de folder sig således, at deres hydrofile aminosyrer vender ud mod vandet. Inderst inde i proteinet vil de hydrofobe aminosyrer samles og interagere med hinanden. Dette vil give den mest stabile struktur, idet de aminosyrer, der ikke kan ”lide” vand, er ”gemt” inde i proteinet. AMP’er vil derimod strukturere sig således, at når de befinder sig nede i cellemembranen og har dannet en transmembran kanal, vil de hydrofobe aminosyrer vende ind mod cellemembranen, mens de hydrofile aminosyrer vil vende ud mod kanalen.
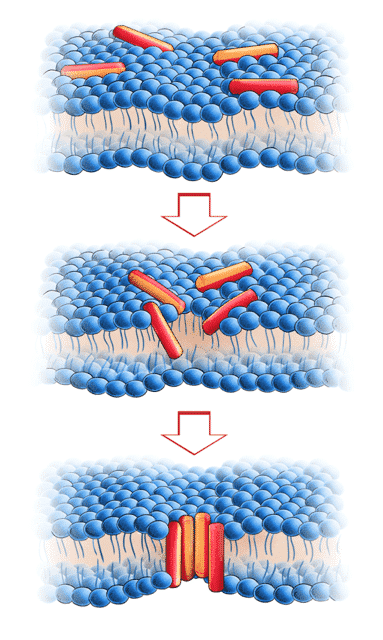
Figur 30. Figuren illustrerer den negativt ladede bakterielle membranoverflade, som AMP’er, på det første billede, binder sig til. AMP’erne tiltrækkes den bakterielle cellemembran på grund af deres positive ladning og kan efterfølgende bore sig ned i membranen og sætte sig dér, hvilket ses på det tredje billede.
Mange funktionelle proteiner består ikke kun af én polypeptidkæde, men derimod af to eller flere polypeptidkæder. Disse kaldes subunits. Proteinets kvartenærstrukur beskriver, hvordan de forskellige polypeptidkæder, eller subunits, vekselvirker med hinanden i et funktionelt proteinkompleks. Proteinets kvarternære struktur holdes sammen af svage bindinger (hydrogenbindinger og hydrofobe vekselvirkninger) samt disulfidbindinger. I mange store, komplekse proteiner vil de forskellige subunits have forskellige funktioner. I nogle proteiner vil man eksempeltvis se, at én subunit er en regulatorisk subunit, der regulerer proteinaktiviteten, mens en anden er en katalytisk subunit, der katalyserer den ønskede reaktion.
AMP’er er meget små molekyler og består kun af en enkel peptidkæde. De har derved ikke i sig selv en kvartenærstruktur. Når AMP’er binder sig til celler vil de finde sammen og danne en transmembran kanal. Eksempeltvis kan nævnes AMP’et trichotoxin (se figur 31), der ved kontakt med cellemembranen danner en transmembran kanal i sæt af 8 identiske peptider. De 8 identiske trichotoxin peptider har derved bundet sig sammen i en kvarternærstruktur. Den hydrofobe del af hvert AMP vender nu ud mod cellemembranen, mens den hydrofile del vil vende ind mod kanalen, der dannes. Det er dermed sekundærstrukturen, der bestemmer, hvor godt AMP’er binder sig til cellemembranen til at starte med, mens det er kvarternærstrukturen, der medfører celledød. Det ses herved, at det er vigtigt at omtale proteinstruktur på flere niveauer for at forstå AMP’ers specfikke virkningsmekanisme.

Figur 31. Når AMP’et, trichotoxin, har bundet sig til cellemembranen, vil 8 identiske peptider danne en transmembran kanal. Trichotoxin peptider sidder herefter i en kvartenærstruktur i cellemembranen.
Et af problemerne ved at benytte antimikrobielle peptider som lægemidler er, at de er proteiner, hvorved de let kan nedbrydes i kroppen af enzymer, der kaldes proteaser. Disse enzymer er stand til at bryde bindingerne mellem aminosyrerne i peptidkæden af AMP’erne. I forbindelse med udvikling af AMP’er som lægemidler er det derfor vigtigt at teste stabiliteten af peptiderne i blodet. Udformning af strategier til at stabilisere AMP’er over for proteaser er en vigtig del af det strukturelle design af peptiderne. En simpel lineær α-helix struktur er relativt følsom over for proteolyse, dvs. nedbrydning af proteaser. Når AMP’er skal designes og bruges som lægemidler, er det derved essentielt at introducere disulfidbindinger, som gør dem mere rigide og bedre i stand til at modstå nedbrydning.
De 20 forskellige aminosyrer er inddelt i undergrupper, alt efter om de er hydrofile, hydrofobe eller specielle. Aminosyrer har både tre-bogstavs- og et-bogstavsforkortelser.