Hormoner, insulin og blodsukkerregulering
Denne underside udgør fjerde del af teorien for Biotech Academys materiale om Diabetes.
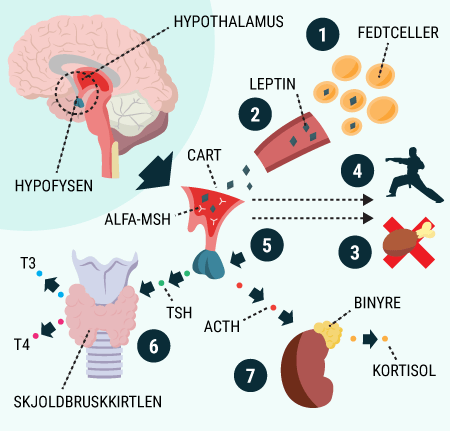
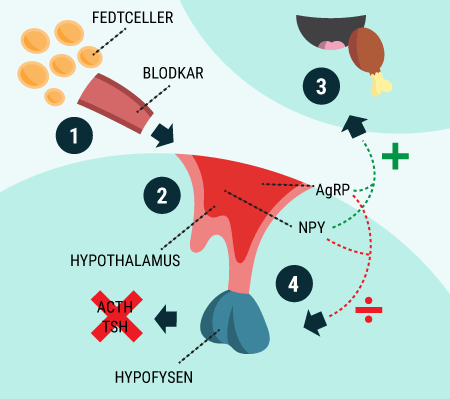
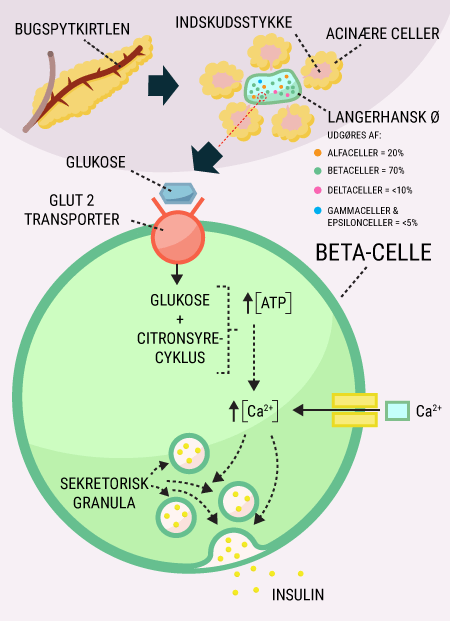
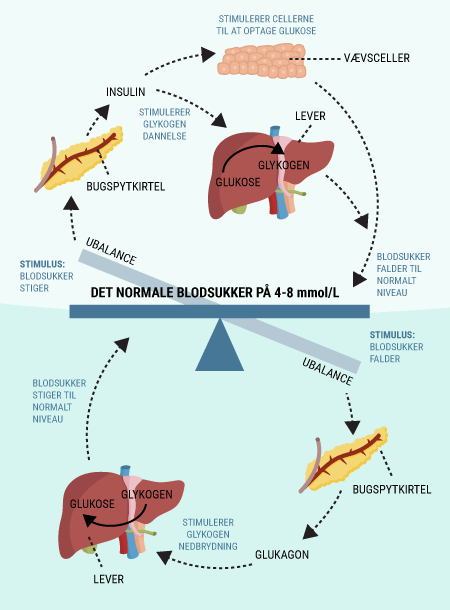
I er nu blevet introduceret til nogle af de vigtige organer i forbindelse med diabetes, herunder fordøjelseskanalen og bugspytkirtlen. Bugspytkirtlen, som producerer og frigiver bl.a. hormonerne glukagon og insulin, spiller en stor rolle for at holde blodsukkeret mere eller mindre konstant. Desuden har I læst om glukoses funktion i kroppen, og om hvordan det lagres, nedbrydes og bruges af kroppens celler. I dette afsnit beskrives, hvorfor mange af disse processer er afhængige af insulin.
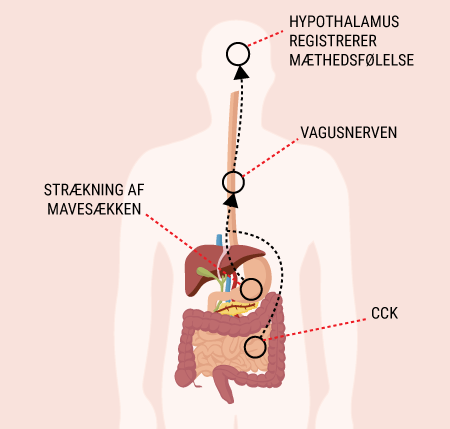
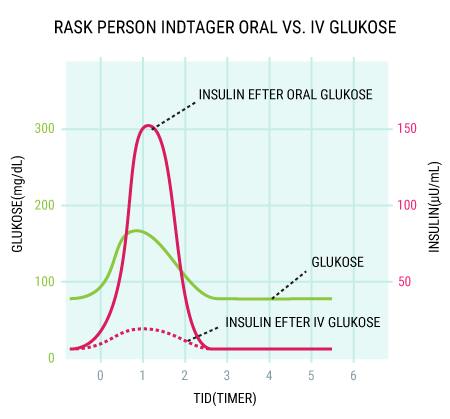
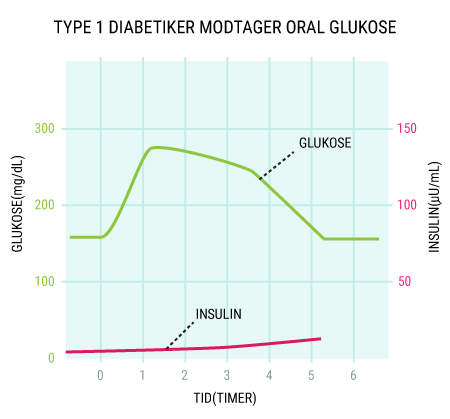
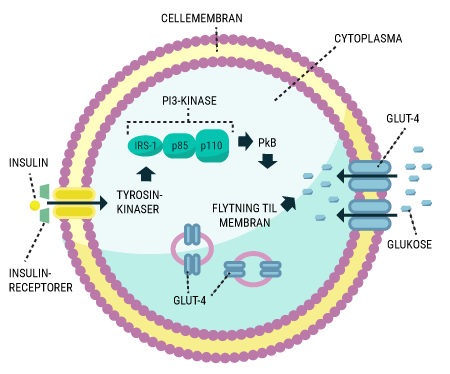
I vil kunne læse om, hvordan de forskellige hormoner, som tidligere er beskrevet, har indvirkning på hinanden, og hvordan de tilsammen sørger for kroppens blodsukkerregulering og dermed opretholdelse af vores liv. I ved nok allerede, at selv kort tids mangel på ilt til hjernen vil medføre alvorlige hjerneskader eller endda død, men vidste I også, at hjernens behov for føde i form af glukose er lige så vigtigt? Selv få minutters mangel på glukose vil medføre bevidstløshed og derefter død, hvis ikke der tids nok bliver givet glukose. Når I har læst denne artikel, vil I vide, hvordan vores appetit reguleres, ligesom I vil have lært om de vigtigste hormoner i forbindelse med mæthedsfølelse. I vil få en forklaring på, hvordan og hvornår insulin frigives, og hvordan blodsukkeret reguleres hos et raskt individ. Og sidst men ikke mindst vil I vide, hvordan insulin virker, når det bliver frigivet til blodet.