Læger kan diagnosticere diabetes hos en person ud fra en kombination af symptomer og et afslørende blodsukkerniveau. Bagefter kan lægen begynde jagten på grunden til, at patientens blodsukker er dårligt reguleret. Dårligt reguleret blodsukker medfører nogle meget typiske symptomer:
Træthed, fordi diabetes medfører, at glukosen i blodet ikke kan transporteres ind i de arbejdende celler. Når cellerne mangler energi (i form af glukose), er de ikke i stand til at udføre samme mængde arbejde.
Polyuri, som betyder at man producerer store mængder urin. Når blodsukkeret bliver højt nok, kan det ikke undgå at blive filtreret fra i nyrerne og ender dermed i urinen. Glukosen har her en osmotisk effekt, og trækker vand med ud. Det betyder, at der i sidste ende kommer store mængder glukoseholdigt urin ud.
Tørst, da forøgelse i blodsukker også medfører forhøjet osmolaritet i blodet. Osmolaritet er et kemisk begreb for antal mol osmotisk aktive partikler per liter opløsning. Fx sukkermolekyler per liter vandig opløsning. I menneskets tørstcenter i hjernens hypothalamus registrerer tørstceller blodets osmotiske tryk. Når blodets osmolaritet stiger, tolker disse tørstceller det som væskemangel, og får hjernen til at tro, at man er tørstig. Samtidig har man naturligvis også temmelig store væsketab via den ekstra mængde urin, man danner, når man har diabetes.
Vægttab, på grund af kroppens dårligere evne til at transportere glukose fra blodet og ind i cellerne, er diabetikere i mindre grad i stand til at lagre sukker fra kosten i leveren og musklerne. En diabetiker får simpelthen mindre ud af sine måltider.
Symptomerne foroven kan indikere, at patienten har diabetes. Men diabetes er en diagnose, man i dag stiller ud fra koncentrationen af hæmoglobin A1c (HbA1c) i patientens blod eller enkeltmålinger af meget højt blodsukker. HbA1c er en type af hæmoglobin i kroppens erytrocytter (røde blodlegemer), som glukose binder til. Koncentrationen af HbA1c er derfor et mål for patientens blodglukosekoncentration over de sidste 120 dage, som er en erytrocyts gennemsnitlige levetid. Intervallet for denne koncentration for raske mennesker er 31-41 mmol/mol (type HbA1c-hæmoglobin per mol af normalt hæmoglobin). Mængden af HbA1c vil være forhøjet hos patienter med diabetes, og i 2011 anbefalede WHO, at diagnosen for diabetes blev sat ved >48 mmol/mol. Yderligere er HbA1c niveauer mellem 41 og 48 mmol/mol lig med en ”prædiabetisk” tilstand. Disse patienter har høj risiko for at udvikle diabetes senere i livet. Blodprøveanalyse af HbA1c kan dog ikke bruges, hvis patienten også har en sygdom, der påvirker hvor lang tid erytrocytterne lever. Denne levetidsforskel findes fx hos patienter med visse blodsygdomme.
Hæmoglobin er et protein i kroppens røde blodlegemer. Hæmoglobin er nødvendigt, for at blodcellerne kan binde ilt, og derpå transportere det fra lungerne og ud til kroppens andre celler. Hæmoglobin indeholder jern, som også er grunden til at blod er rødt.
| TEST |
SUKKERKONCENTRATION I BLODET |
| Blodglukosekoncentration efter faste |
>/= 7 mmol / L |
| eller blodglukosekoncentration 2 timer efter indtag af 75 g glukose |
>/= 11,1 mmol / L |
| eller tilfældig blodprøve, hvis patienten har symptomer |
>/= 11,1 mmol / L |
I disse tvivlstilfælde kan lægen bruge en anden metode til at vurdere, hvorvidt patienten har problemer med blodsukkerreguleringen. Denne metode indebærer, at blodets glukoseniveauer bliver målt, både efter faste og 2 timer efter indtagelse af 75 gram glukose. Denne undersøgelse kaldes Oral Glukose Tolerance Test (OGTT), og kan stadig bruges diagnostisk for diabetes. Undersøgelsen med måling af HbA1c har den fordel, at patienterne ikke behøver at faste inden undersøgelsen, og lægen blot skal bruge en blodprøve. Herunder vises, hvad niveauerne af blodglukose skal være, for at diabetes bliver diagnosticeret. Diabetes diagnosen kræver at patienten har mere end én måling af blodglukose eller Hba1c i diabetisk niveau.
Efter diabetes er blevet diagnosticeret, er man nødt til at finde sygdommens årsag, da behandlingerne er afhængige af diabetestypen. Et dysreguleret (dårligt reguleret) blodsukker, kan som sagt skyldes mange ting.
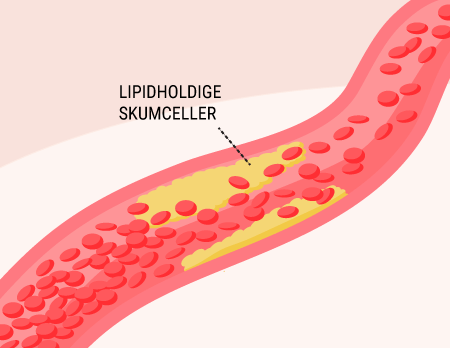
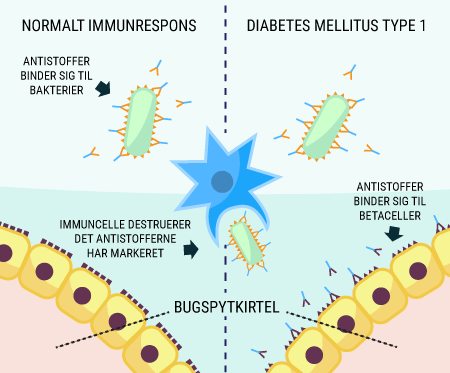
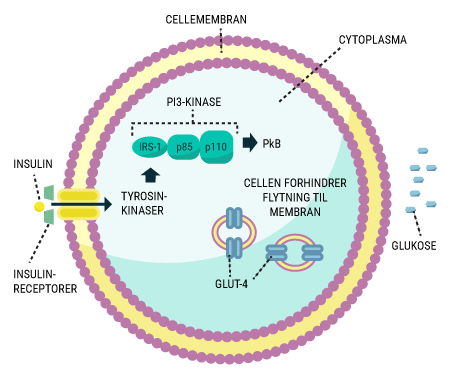
Den langt hyppigste årsag til diabetes, er patienternes livsstil. Diabetes Mellitus Type 2, som er den ”erhvervede” form, står stadig for 80% af al diabetes i Danmark. Forskning har vist at, faktorer som overvægt, for fed ”energi-rig” kost og manglende motion forøger risikoen for at udvikle bestemte former for diabetes. I disse tilfælde mener man, at kroppens celler udvikler grader af insulinresistens, hvilket beskrives senere i denne artikel. Diabetikerens genetik kan også spille en rolle for dysregulering af blodsukkeret, se senere. De sidste par år er forskere også begyndt at kigge på tarmenes mikrobiom og på hvordan gode og skadelige bakterier i tarmen hver især påvirker diabetespatienterne. Det har vist sig, at mikrobiomet kan spille en temmelig stor betydning for udviklingen af sygdommen, men præsenterer også muligheder i behandlingen af nogle typer diabetes.
Mikrobiomet er en betegnelse for alle de levende organismer, som bor på og inden i os mennesker, som ikke er vores egne celler. Det dækker blandt andet over hudbakterier, men vigtigere for diabetespatienter også organismer i tarmen. Læs mere her!
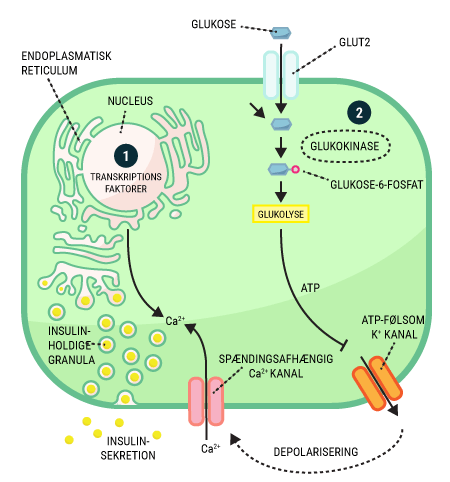
Diabetisk ketoacidoseInsulinkrævende diabetes kan være akut livsfarligt, fordi dårligt reguleret blodsukker bl.a. kan medføre en livstruende tilstand med diabetisk ketoacidose. Cellerne skal bruge glukose i deres energikrævende processer. Hvis cellerne ikke kan få adgang til glukose, begynder cellerne at forbrænde andre energikilder, især fedt fra kroppens depoter. Under normale forhold bliver frigørelsen af fedtsyrer hæmmet af insulin ude i fedtcellerne (adipocytterne). Derfor stiger mængden af fede syrer i blodet ved insulinmangel. Ved høje koncentrationer af frie fede syrer i blodet, går leveren i gang med at lave ketonstoffer (acetoacetat og D-3-hydroxybutyrat). De bliver lavet fra fedtstoffer og aminosyrer og anvendes især af muskelceller og hjerneceller. Der er energi nok i ketonstofferne, men hvis koncentrationen af ketonstoffer i blodet er for høj i for lang tid, så begynder blodets pH at falde uden for hvad der er normalt. En tilstand der kaldes acidose. Dette er en meget farlig tilstand, da alle kroppens funktioner er indstillet til at fungere optimalt ved pH i intervallet 7,35-7,45. Patienter med ketoacidose får kvalme, kaster op, vil være uklare i hovedet og har en risiko for at gå i koma på grund af den lave pH. Man kan faktisk mærke den acetone-agtige lugt af neglelakfjerner i udåndingsluften hos patienter med ketoacidose.