Undvigelse af immunsystemet
Kroppens bekæmpelse af malaria
Malaria er som beskrevet i afsnittet ’Malaria og kroppen’ yderst skadeligt for den menneskelige organisme, og det er derfor kroppens højeste prioritet at bekæmpe en igangværende malariainfektion. Her spiller antistoffer og T-celler en afgørende rolle, ligesom ved andre infektionssygdomme.
Som det står beskrevet i artiklen om immunsystemet, kaldes det aktiv immunisering, når immuniseringen foregår gennem en aktivering af vores eget immunsystem. Med denne metode kan kroppen gøre modstand mod malariainfektionen på flere forskellige stadier.
Det invaderende stadie er et af de første stadier, og under dette kan såkaldte antistofreaktioner fremkaldes mod sporozoitter (se fanen ”Malaria og kroppen”). En bekæmpelse af disse sporozoitter kan forhindre, at levercellerne inficeres. På den måde bliver infektionen stoppet i et af dens første stadier. Yderligere findes der særlige cytotoksiske (celledræbende) T-celler (TC-celler) med receptorer, som aktiveres ved binding med MHC-I + antigen. Disse aktiverede TC-celler udviser cytotoksicitet over for inficerede leverceller. Når disse TC-celler dræber de inficerede leverceller, kan frigivelsen af merozoitter fra leveren til blodbanen forhindres, og infektionen stoppes derved før sygdommen bryder ud.
Thjælper-celler (TH-celler) er derimod vigtige i bekæmpelsen af de næste trin af parasitinfektionen, nemlig stadiet hvor parasitter befinder sig i de røde blodlegemer (se fanen ”Malaria og kroppen”). TH-celler stimulerer antistofproduktionen og udskiller en særlig slags immunregulerende signalstoffer (cytokiner). Cytokiner kan bl.a. medvirke til aktivering af makrofager, som så angriber inficerede røde blodlegemer.
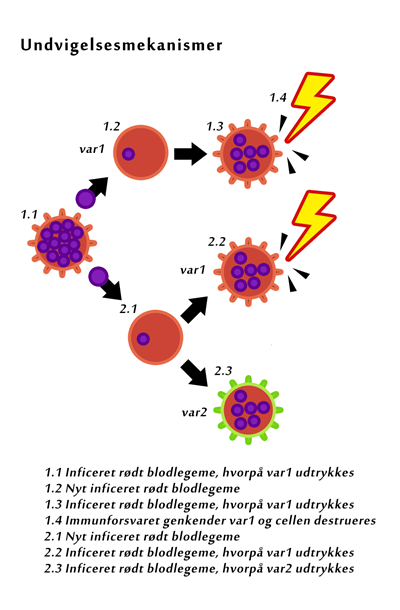
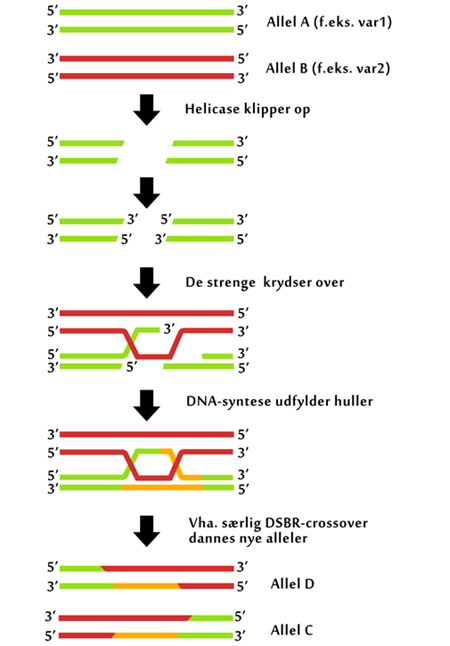
Yderligere kan antistoffer mod særlige molekyler på merozoit-overfladen bryde parasittens cyklus ved at blokere merozoit-invasion af nye røde blodlegemer, idet merozoitten benytter disse overflademolekyler til at binde og trænge ind i nye røde blodlegemer.
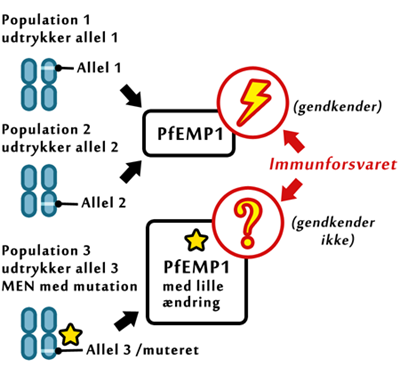
Ud over at bekæmpe selve parasitten gennem immunitet kan kroppens immunforsvar også forhindre de skadelige processer som parasitinfektionen forårsager, og som gør den så farlig. Bl.a. kan antistoffer mod overfladeproteinet PfEMP1 på de inficerede røde blodlegemer forhindre, at disse binder sig til endotelcellerne, hvilket ellers er tilfældet med blodpropperne i de små blodkar i hjernen (se næste afsnit). Således kan man undgå en af de farligste konsekvenser af malariainfektionen.
Inficerede individer kan i en vis grad også udvikle såkaldte transmissions-blokerende antistoffer. Disse antistoffer genkender molekyler udtrykt af den kønnede form af parasitten (gametocytter) og forstyrrer derved udviklingen af parasitter i myggen. Transmissions-blokerende antistoffer rammer dog hovedsagelig stadier, som kun findes i myggen (fx oocyst stadierne), og da mennesket aldrig kommer i kontakt med disse, kan kroppen ikke udvikle immunitet over for disse antistoffer. Dog kan man ved immunisering gennem vacciner inducere sådanne transmissions-blokerende antistoffer.
Derved kan immunresponser mod parasitter bidrage til reduktion af både sygdommens sværhedsgrad og dens udstrækning ved at udrydde parasitterne, forhindre sygdomsforløbet (patogenesen) og stoppe spredningen.
Mange af disse forskellige slags immunrespons bliver netop fokus for udviklingen af vacciner (se fanen “Vacciner”).