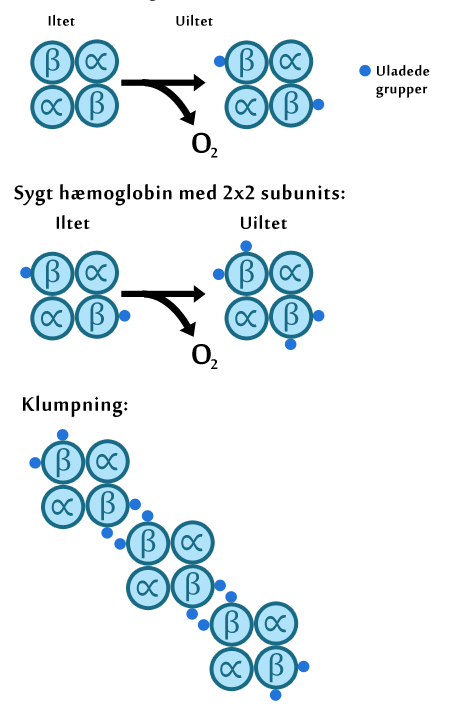
Der forekommer mange genetiske variationer med forekomst af seglcellegenet, hvoraf de mest almindelige er:
- Seglcelletræk, hvor individet kun har en enkel allel som koder for Hb-S, men samtidig et raskt gen. Derfor vil der her både være raske og syge røde blodlegemer til stede hos disse personer. De lever som udgangspunkt uden symptomer, men kan ved svær udmattelse opleve komplikationer forbundet med seglcelleanæmi.
- Seglcelleanæmi, her er stort set alle Hb-A erstattet med Hb-S, og individer med dette vil både opleve kronisk anæmi og skadet milt som følge af overbelastning pga. det store antal blodlegemer, den skal nedbryde. Disse individer kan med behandling blive op til 50 år.
- Seglcelle – hæmoglobin SC sygdom eller fx beta-thalassæmi, hvor individet både har Hb-S og et andet defekt globingen. Dette forårsager ligeledes anæmi og alt efter hvilket andet sygt gen også ofte jernophobning, jernmangel eller andre alvorlige konsekvenser.
Som beskrevet ovenfor er seglcelleanæmi en alvorlig sygdom med kun få forbedrende behandlinger såsom blodtransfusioner i perioder, folatsubstitution (1 mg folinsyre om dagen, idet folinsyre er vigtigt for dannelsen af nye røde blodlegemer) og et stof kaldet hydroxyurea, som stimulerer erythropoiesen, dvs. dannelsen af de røde blodlegemer.
Der er dog ét plus ved sygdommen: som nævnt tidligere nedsætter den stærkt risikoen for at malaria kan udvikle sig i kroppen.
Mens malariaparasitten befinder sig i de røde blodlegemer, inducerer den både Hb-S og Hb-A til at gå til ikke-iltede former gennem en mekanisme, der kaldes Bohr effekten. Bohr effekten går ud på, at når placeret i et surt eller CO2-holdigt miljø, vil både Hb-A og Hb-S have en tendens til at frigive deres oxygen og altså konvertere til deoxygeneret form. I inficerede røde blodlegemer vil malariaparasittens metabolisme danne CO2 som et affaldsprodukt. CO2 bliver i vandige miljøer (i det røde blodlegeme) omdannet til kulsyre. Kulsyre er som navnet viser, en syre, og som følge af de store mængder af dette, vil hæmoglobinet i et parasitinficeret rødt blodlegeme forekomme på ikke-iltet form. Som beskrevet tidligere vil de røde blodlegemer, når på den ikke-iltede form, aggregere, dvs. klumpe sammen (se figur 14).
Ideen bag samspillet mellem CO2 og de røde blodlegemers villighed til at afgive ilt er smart i den raske krop. Når de røde blodlegemer befinder sig i blodkar i vævene, særligt i aktive væv, hvor der produceres meget CO2, er det en fordel, at de røde blodlegemer er mere villige til at afgive deres ilt. Dette sikrer at selv meget aktive og derfor iltkrævende væv, får en tilstrækkelig mængde ilt. Det modsatte princip foregår i lungerne, hvor de røde blodlegemer er særligt villige til at binde ilt. Denne sammenhæng optimerer transporten af ilt rundt i kroppen, så iltforbruget i vævene passer med ilttilførslen. Dog er denne sammenhæng mellem CO2 og af-iltning af de røde blodlegemer som sagt skadelig, hvis man har sygdommen seglcelleanæmi.
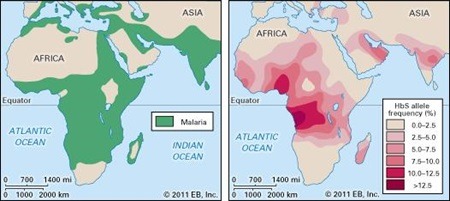
Disse sammenhænge mellem seglcelleanæmi og malariaparasitternes mistrivsel forklarer antallet af seglcelleramte på verdensplan. Sygdommen forekommer nemlig oftest hos negroide, især i de tropiske områder i Afrika, hvor op til 20 % er raske heterozygote bærere af sygdommen (figur 15). Dette ses, idet der er en klar overlevelsesmæssig fordel og dermed også en naturlig udvælgelse af bærere af dette gen i områder med høj forekomst af malaria.