Fermentering: En bæredygtig proces eller ej?
Fermentering kan være bæredygtigt i forhold til andre produktionsformer. For eksempel, som i case 3, hvor det forklares, at man kan producere insulin ved fermentering, fremfor at ekstrahere det fra bugspytkirtlen fra tusindvis af køer og grise.
Som du også har lært, skal produktionsorganismerne bruge energi, for at fungere som cellefabrikker. Energien tilsættes oftest i form af sukker. Sukkeret kommer fra plantager, som konkurrerer om landarealet med afgrøder til menneskeføde og også risikerer at mindske biodiversiteten på området hvor de dyrkes.
Et eksempel er ethanol, som primært produceres af gærsvampen Saccharomyces cerevisiae. For at producere 1 g ethanol med S. cerevisiae, skal der bruges ca. 2 g sukker. Når nogle ethanolfabrikker producerer omkring 10.000 kg ethanol pr. dag, og derfor skal de bruge enorme mængder af sukker. Dette gælder ikke kun for ethanolproduktion, men også for produktion af alle andre fermenterede produkter som insulin og enzymer. Mange produkter giver endda et markant lavere udbytte end ethanol, hvilket medfører at der skal bruges flere kilogram sukker hver gang et kilogram produkt skal fremstilles. Sukkerforbruget i industrielle fermenteringer er derfor et problem, når vi taler om grøn omstilling.
Anvendelse af Alger i Fermenteringsprocessen
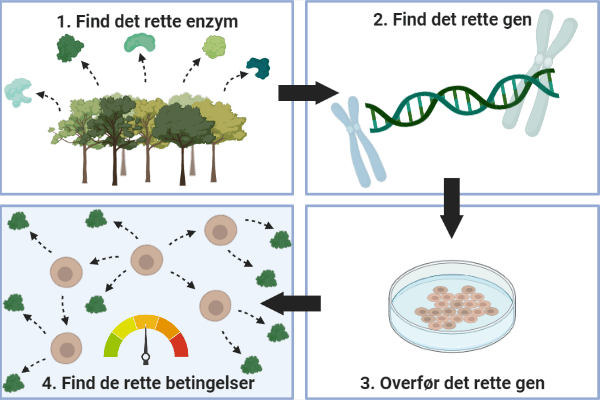
På grund af udfordringerne ved at bruge sukker til fermentering, forslår forskere fra Københavns Universitet nu, at alger kan være løsningen på dette problem. Helt konkret har forskerne arbejdet med algen Nannochloropsis oceanica, som er en encellet mikroalge, der lever naturligt i havet. Alger er organismer, som deler mange fællestræk med landplanterne – blandt andet evnen til at lave fotosyntese. Dette er smart fordi algen danner sit egent sukker, ved hjælp af sollys og CO2. Tænk hvis man kunne fermentere ved at fodre produktionsorganismerne med CO2 fremfor sukker (se figur 1).
På grund af de beskrevne problemer med sukker som fødekilde, ville algefermentering få positive konsekvenser for biodiversiteten og drivhuseffekten. En anden fordel ved alger er, at de er eukaryoter, hvilket gør dem i stand til at danne mere avancerede molekyler end prokaryoter. Derfor vil de som cellefabrikker kunne udnyttes til at producere bl.a. pigmenter og medicinske molekyler.
- oceanica er også god til at danne høje koncentrationer af lipider, hvilket muligvis kunne bruges til olier og erstatte den problematiske palmeolie, som også er årsag til fældninger af regnskovsareal.
Yderligere er det muligt at genmodificere N. oceanica med høj effektivitet. Den egenskab er vigtig, når det handler om at finde en god produktionsorganisme, fordi nogle organismer er svære at genmodificere. På den måde vil du kunne bruge den samme organisme til at lave mange forskellige produkter og ikke behøve at optimere din fermenteringsopsætning til en ny art, hver gang et nyt produkt skal i produktion.

Figur 1: Mikroalger muliggør udnyttelse af CO2 som den primære kulstofkilde til produktionsorganismer. Dette er et resultat af algers evne til at lave fotosyntese. Ved at bruge alger fremfor bakterier og gær kan man undgå at anvende sukker, der kræver store landbrugsarealer.
Hvorfor bruger vi ikke allerede alger fremfor bakterier og svampe?
Historisk set har alger ikke været brugt i industrien. For fermenteringsfabrikkerne betyder det, at implementeringen af alger sandsynligvis kræver store investeringer, da fermenteringstankene skal tilpasses til alger. Hvis vi går ud fra, at målet er at forsyne algerne med CO2 fra omgivelserne, er det også vigtigt at udvikle en metode til at fange og introducere CO2 en til fermenteringstankene. Derudover findes der ikke meget forskning på området, så der ville være høje udviklingsomkostninger forbundet med at bruge alger til fermentering. Dette er finansielt risikabelt, da der allerede er cellefabrik systemer, som fungerer godt til bakterier og svampe. En anden hage er, at algerne gror langsommere end andre produktionsorganismer, så produktiviteten ville være langsommere (se teorien om Vækst og produktion). Det er altså afgørende for implementeringen af alger, at de alge-fermenterede produkter kan markedsføres til en konkurrencedygtig pris.
Hvad kan vi gøre for at algerne kan implementeres i fremtiden?
For at implementere alger som en del af fermenteringsprocesserne vil det være oplagt at undersøge, om man kan optimere proteinproduktionen med N. oceanica. Dette kunne gøres store genmodificerings forsøg, efterfulgt af eksperimenter i laboratorieskala, hvor man undersøger, om algens vækst og/eller produktivitet er øget efter DNA-ændringen. En måde at undersøge algers vækst er ved at gro dem i næringsmedie og måle absorbansen over tid. Jo flere alger der er, jo grønnere bliver mediet, og absorbansen vil stige. Til at bestemme produktiviteten skal du kende produktkoncentrationen over tid. Den kan man finde ved at tage prøver undervejs i sit laboratorieskalaeksperiment og analysere produktkoncentrationen ved brug af bl.a. kromatografiske, enzymatiske eller spektroskopiske metoder.
Grundet den sparsomme viden om alger, er det en mulighed, at der findes alger ude i verden, der er bedre egnede som produktionsorganismer end dem, som allerede er fundet. Visse alger besidder evnen til at udføre fotosyntese, selv i miljøer som mudder og jord, hvor mængden af sollys er begrænset. På samme måde kan der gemme sig andre nye algerarter med spændende egenskaber, som er svære at få øje på.
Realistisk set vil der nok gå mange år, før alger kan blive implementeret som en produktionsorganisme, grundet de finansielle udfordringer og manglende viden. Ikke desto mindre er det en mulighed, som har direkte positive påvirkninger på klimaet og som vil bliver undersøgt af forskere.
Hvorfor bruger vi ikke allerede alger fremfor bakterier og svampe?
Historisk set har alger ikke været brugt i industrien. For fermenteringsfabrikkerne betyder det, at implementeringen af alger sandsynligvis kræver store investeringer, da fermenteringstankene skal tilpasses til alger. Hvis vi går ud fra, at målet er at forsyne algerne med CO2 fra omgivelserne, er det også vigtigt at udvikle en metode til at fange og introducere CO2 en til fermenteringstankene. Derudover findes der ikke meget forskning på området, så der ville være høje udviklingsomkostninger forbundet med at bruge alger til fermentering. Dette er finansielt risikabelt, da der allerede er cellefabrik systemer, som fungerer godt til bakterier og svampe. En anden hage er, at algerne gror langsommere end andre produktionsorganismer, så produktiviteten ville være langsommere (se teorien om Vækst og produktion). Det er altså afgørende for implementeringen af alger, at de alge-fermenterede produkter kan markedsføres til en konkurrencedygtig pris.
Hvad kan vi gøre for at algerne kan implementeres i fremtiden?
For at implementere alger som en del af fermenteringsprocesserne vil det være oplagt at undersøge, om man kan optimere proteinproduktionen med N. oceanica. Dette kunne gøres store genmodificerings forsøg, efterfulgt af eksperimenter i laboratorieskala, hvor man undersøger, om algens vækst og/eller produktivitet er øget efter DNA-ændringen. En måde at undersøge algers vækst er ved at gro dem i næringsmedie og måle absorbansen over tid. Jo flere alger der er, jo grønnere bliver mediet, og absorbansen vil stige. Til at bestemme produktiviteten skal du kende produktkoncentrationen over tid. Den kan man finde ved at tage prøver undervejs i sit laboratorieskalaeksperiment og analysere produktkoncentrationen ved brug af bl.a. kromatografiske, enzymatiske eller spektroskopiske metoder.
Grundet den sparsomme viden om alger, er det en mulighed, at der findes alger ude i verden, der er bedre egnede som produktionsorganismer end dem, som allerede er fundet. Visse alger besidder evnen til at udføre fotosyntese, selv i miljøer som mudder og jord, hvor mængden af sollys er begrænset. På samme måde kan der gemme sig andre nye algerarter med spændende egenskaber, som er svære at få øje på.
Realistisk set vil der nok gå mange år, før alger kan blive implementeret som en produktionsorganisme, grundet de finansielle udfordringer og manglende viden. Ikke desto mindre er det en mulighed, som har direkte positive påvirkninger på klimaet og som vil bliver undersøgt af forskere.
Hvorfor bruger vi ikke allerede alger fremfor bakterier og svampe?
Historisk set har alger ikke været brugt i industrien. For fermenteringsfabrikkerne betyder det, at implementeringen af alger sandsynligvis kræver store investeringer, da fermenteringstankene skal tilpasses til alger. Hvis vi går ud fra, at målet er at forsyne algerne med CO2 fra omgivelserne, er det også vigtigt at udvikle en metode til at fange og introducere CO2 en til fermenteringstankene. Derudover findes der ikke meget forskning på området, så der ville være høje udviklingsomkostninger forbundet med at bruge alger til fermentering. Dette er finansielt risikabelt, da der allerede er cellefabrik systemer, som fungerer godt til bakterier og svampe. En anden hage er, at algerne gror langsommere end andre produktionsorganismer, så produktiviteten ville være langsommere (se teorien om Vækst og produktion). Det er altså afgørende for implementeringen af alger, at de alge-fermenterede produkter kan markedsføres til en konkurrencedygtig pris.
Hvad kan vi gøre for at algerne kan implementeres i fremtiden?
For at implementere alger som en del af fermenteringsprocesserne vil det være oplagt at undersøge, om man kan optimere proteinproduktionen med N. oceanica. Dette kunne gøres store genmodificerings forsøg, efterfulgt af eksperimenter i laboratorieskala, hvor man undersøger, om algens vækst og/eller produktivitet er øget efter DNA-ændringen. En måde at undersøge algers vækst er ved at gro dem i næringsmedie og måle absorbansen over tid. Jo flere alger der er, jo grønnere bliver mediet, og absorbansen vil stige. Til at bestemme produktiviteten skal du kende produktkoncentrationen over tid. Den kan man finde ved at tage prøver undervejs i sit laboratorieskalaeksperiment og analysere produktkoncentrationen ved brug af bl.a. kromatografiske, enzymatiske eller spektroskopiske metoder.
Grundet den sparsomme viden om alger, er det en mulighed, at der findes alger ude i verden, der er bedre egnede som produktionsorganismer end dem, som allerede er fundet. Visse alger besidder evnen til at udføre fotosyntese, selv i miljøer som mudder og jord, hvor mængden af sollys er begrænset. På samme måde kan der gemme sig andre nye algerarter med spændende egenskaber, som er svære at få øje på.
Realistisk set vil der nok gå mange år, før alger kan blive implementeret som en produktionsorganisme, grundet de finansielle udfordringer og manglende viden. Ikke desto mindre er det en mulighed, som har direkte positive påvirkninger på klimaet og som vil bliver undersøgt af forskere.
Arbejdsspørgsmål:
- Hvor stort et landbrugsareal der skal bruges til at lave 10 kg ethanol vha. svampen Saccharomyces cerevisiae? .
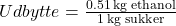 . Produktion af 1 kg sukkerrør optager ca. 0,7 m2 hvoraf 10% sukkerrør kan omdannes til ren sukker.
. Produktion af 1 kg sukkerrør optager ca. 0,7 m2 hvoraf 10% sukkerrør kan omdannes til ren sukker.