Mikrobiotaens betydning
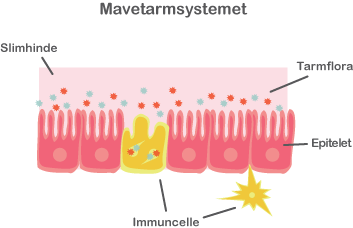
Mikrobiotaen har stor betydning for fordøjelseskanalen, hvor den påvirker immunsystemet og har vigtige fysiologiske og metaboliske roller. Mikrobiotaen kan faktisk betragtes som et organ, der erhverves efter fødslen (postnatalt).
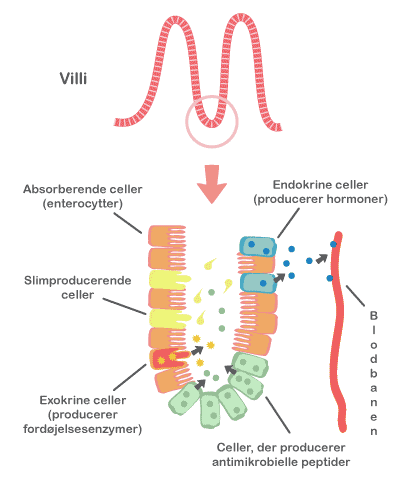
For at forstå mikrobiotaens betydning kan man sammenligne almindelige mus med kimfri mus, som ikke har nogen mikrobiota. Det ses bl.a., at mikrobiotaen påvirker værtens genekspression, der regulerer næringsoptagelse og metabolisme samt postnatal modning af fx tarmepitelet og immunsystemet.
Næringsoptagelsen påvirkes af mikrobiotaen. For eksempel skal kimfri mus indtage 30 % mere energi for at opretholde kropsvægten end mus med normal mikrobiota. Hos kimfri mus er der også større ekspression af gener involveret i absorption af kulhydrater, i nedbrydning og absorption af komplekse fedtstoffer og i absorption og lagring af mikronæringsstoffer (fx mineraler og vitaminer). Dette tyder på, at musekroppen arbejder hårdt på at få så meget som muligt ud af den indtagne mad. Kimfri mus har også mindsket vandabsorption i tarmen i forhold til normale mus, hvilket medfører diarré.
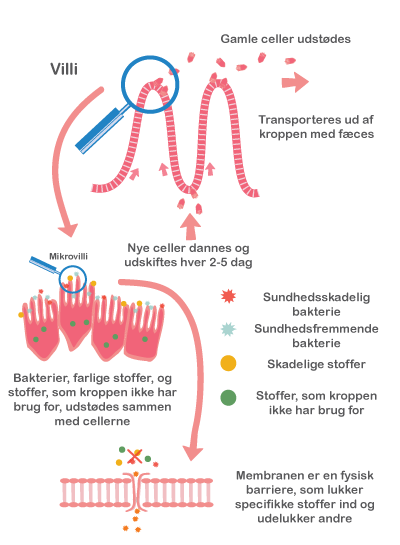
Kimfri mus har fysiologiske forskelle i forhold til normale mus. De har en deform tarm, hvor tyndtarmen vejer mindre sandsynligvis pga. manglende immunceller og en op mod 8 gange større caecum (det første stykke af tyktarmen, hvor tyndtarmen udmunder) end normalt pga. tilbageholdelse af vand. De kimfri mus har mindsket bevægelighed af tarmen, og de har et unormalt tarmepitel med mindre overfladeareal.
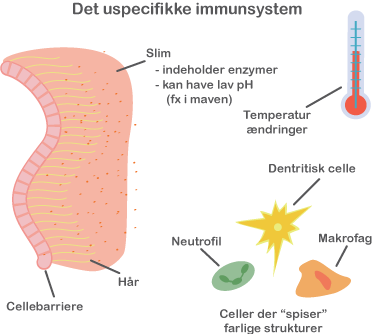
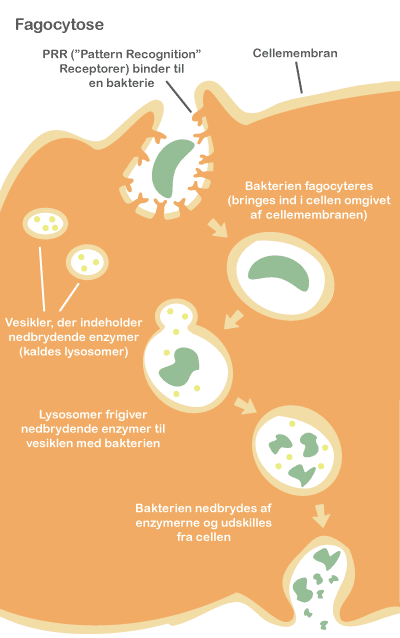
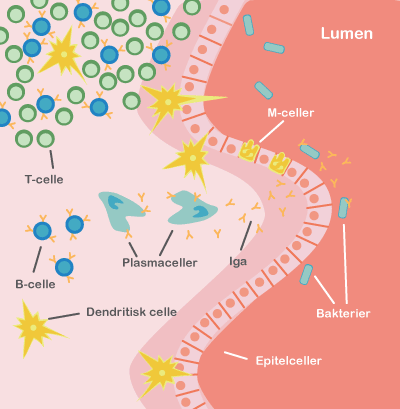
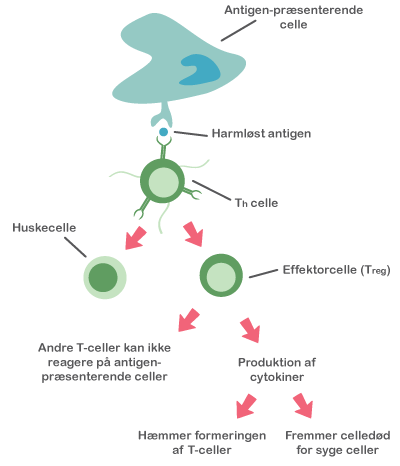
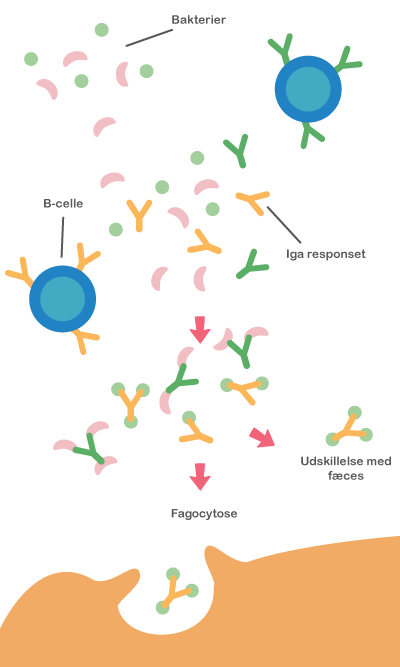
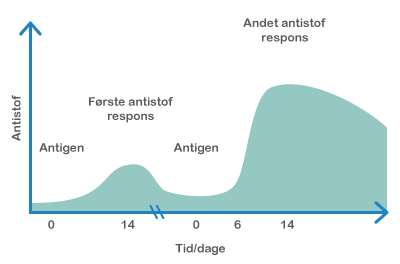
Mikrobiotaen påvirker desuden immunsystemet. Immunsystemet er nemlig fra fødslen umodent, og det menes, at den postnatale (’efter fødslen’) etablering af en balanceret mikrobiota påvirker immunsystemets funktioner markant. Hos de kimfri mus blev det observeret, at lymfeknuderne er underudviklede, at der er et reduceret antal immunceller i epitelet, og at der kun er få T-celler og IgA-producerende B-celler under epitelet. Desuden er epitelcellecyklusen forlænget, og immunsystemets organer uden for mavetarmkanalen, milten og brislen (thymus), er mindre i størrelse. Mindsket mikrobiel kontakt i den tidlige barndom associeres i øvrigt med den stigende forekomst af allergi i den vestlige verden.