Sundhedsfremmende bioaktiv kost
Chr. Hansen og Institut for Systembiologi, byder dig velkommen til projektet ”Sundhedsfremmende bioaktiv kost”. Projektet er udarbejdet af Eva Roitmann i samarbejde med begge partnere. Gennem projektet vil du bl.a. lære om, hvordan probiotiske bakterier hjælper din krop med at holde dig sund. Projektet indeholder en række artikler der kan benyttes enkeltvis eller som et samlet undervisningsforløb. Materialet er specielt velegnet til undervisning i biologi og bioteknologi. Teorien er suppleret af to eksperimentelle øvelser, der primært henvender sig til biologi og bioteknologi.
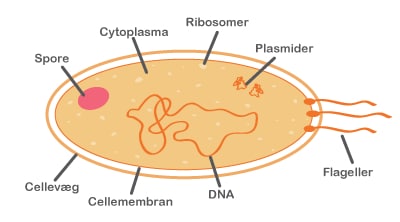
I dag er samfundet meget fokuseret på, at folk skal leve sundt. Man er bevidst om, at kosten har stor indflydelse på, om vi har det godt. Det er ikke kun fordi, vi skal have den rigtige mængde essentielle stoffer, dvs. kulhydrater, fedtstoffer, proteiner, vitaminer og mineraler, men også fordi der i kosten findes bioaktive komponenter. Bioaktive komponenter kan enten påvirke kroppen på en god eller på en dårlig måde. En række stoffer har således en negativ virkning på kroppen såsom kræftfremkaldende farvestoffer. Der findes også masser af sundhedsfremmende komponenter i kosten, og dette projekt handler om to sådanne komponenter, nemlig probiotika (hovedsageligt sunde bakterier) og præbiotika (som regel fibre).
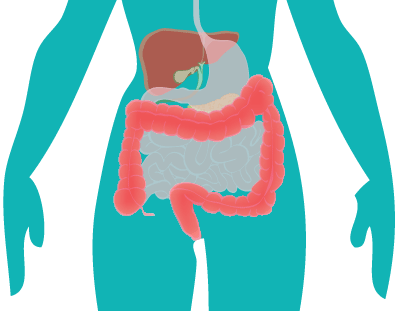
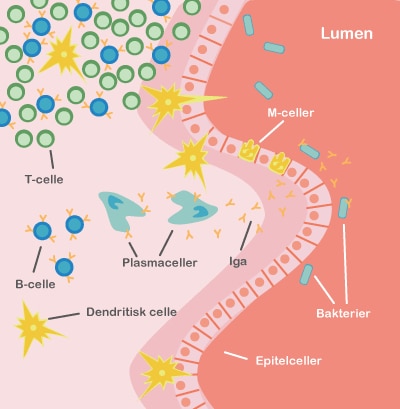
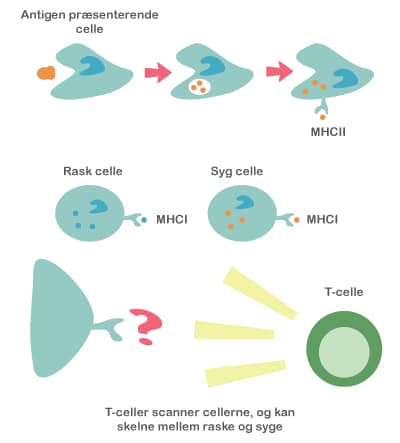
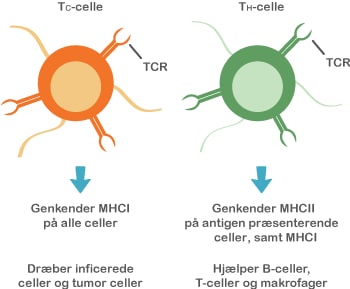
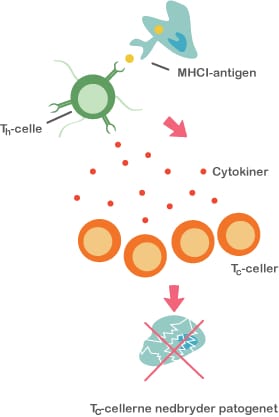
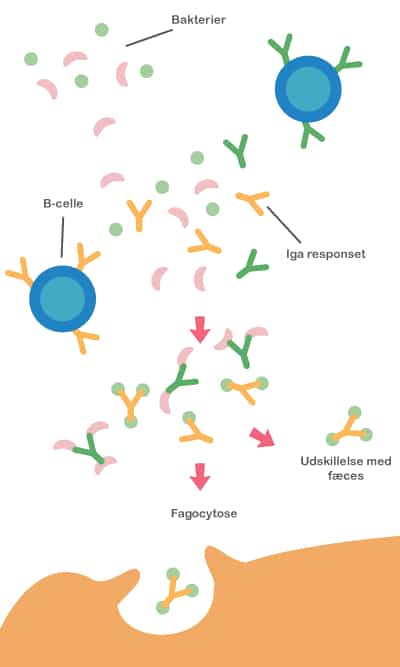
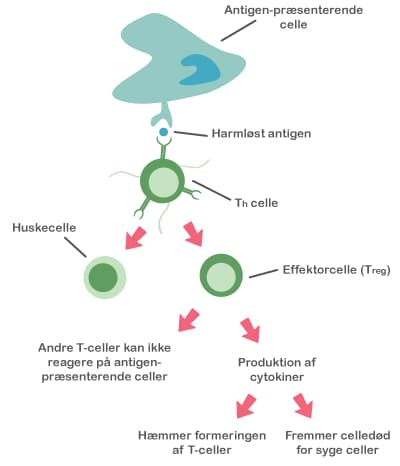
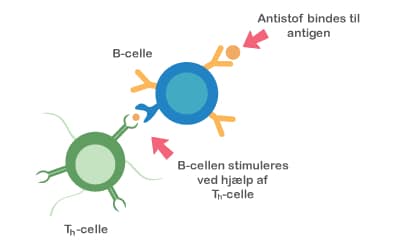
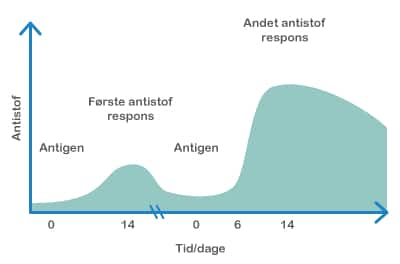
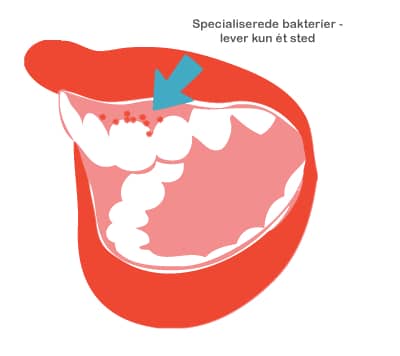
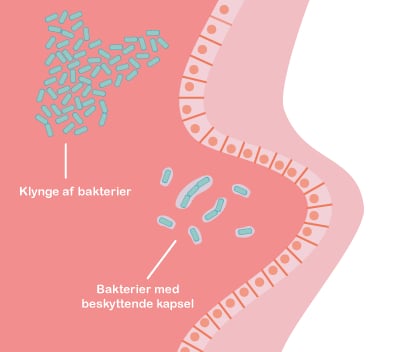
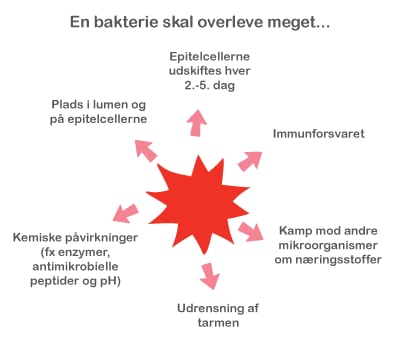
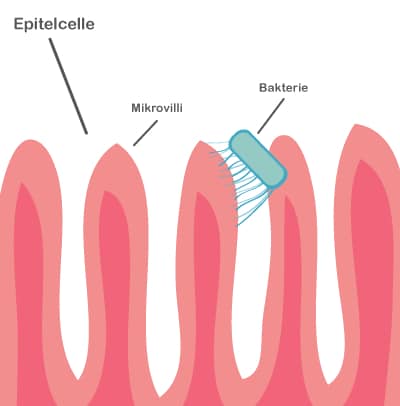
Både probiotika og præbiotika hjælper til at holde maven sund ved at skabe en balanceret tarmflora. Det er vigtigt med en sund mave, for det er netop her, at kroppen er meget udsat for farlige komponenter, da vores mad indeholder utallige mikroorganismer og potentielt skadelige stoffer. Desuden ligger 70 % af immunsystemet i mavetarmkanalen, og en sund tarmflora påvirker immunsystemet på en god måde.