Hvordan måler man en biomarkør?
Del 2 af 4 i forløbet: Biomarkører
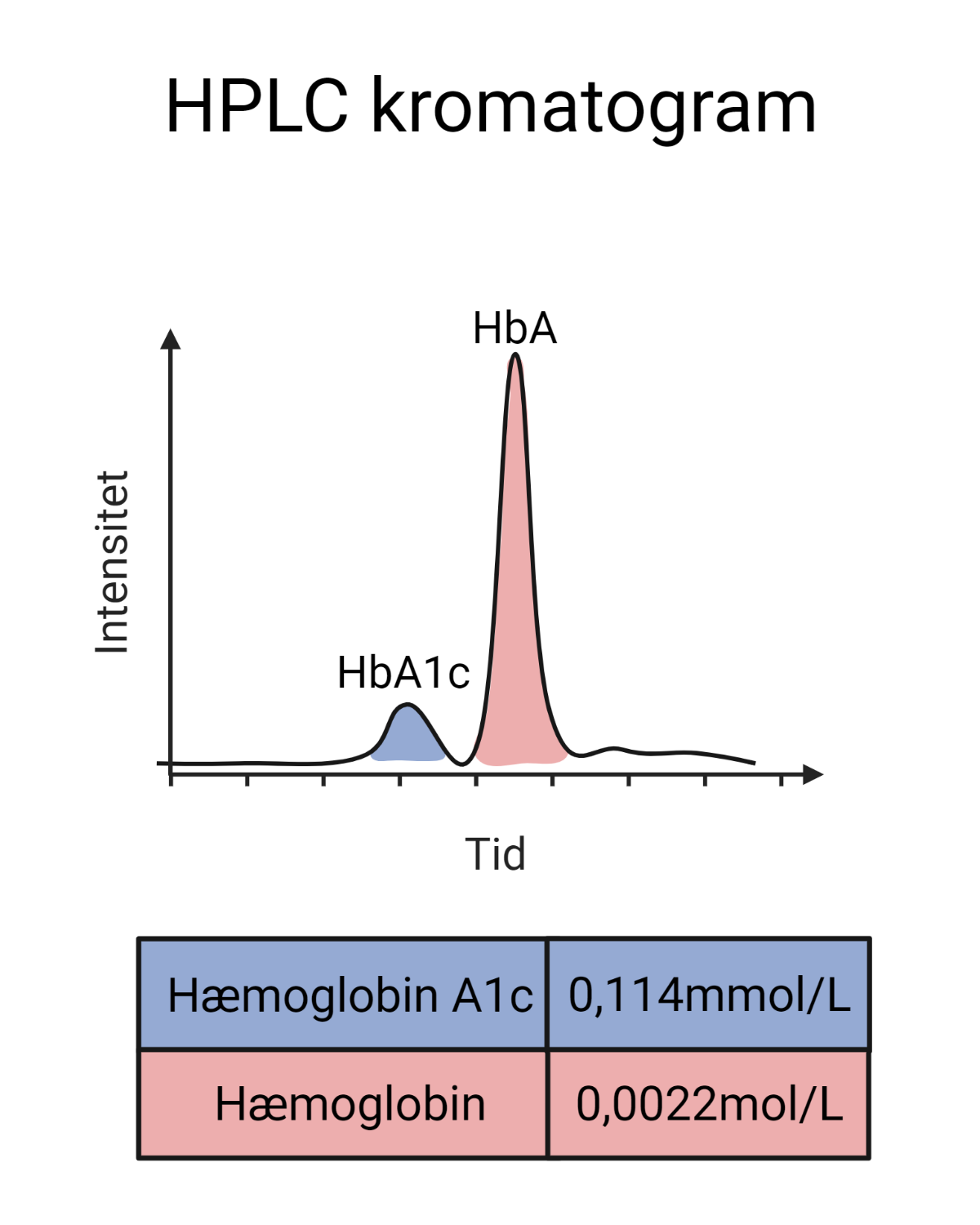
I sidste afsnit lærte du om fire forskellige slags biomarkører: Molekylære, radiografiske, histologiske og fysiologiske biomarkører. Inden for hver kategori findes der forskellige undertyper af biomarkører. For eksempel består de molekylære biomarkører af DNA, proteiner, fedtstoffer og mange andre molekyler. Med så stor diversitet i biomarkørerne medfølger der naturligvis også en helt masse forskellige målemetoder. Nogle af målemetoderne kræver avanceret og dyrt udstyr, mens andre af målemetoderne er simple og kan udføres derhjemme. I dette afsnit lærer du om nogle af teknikkerne til at måle på forskellige biomarkører, og til sidst går vi i dybden med de molekylære biomarkører: DNA og proteiner.
Radiografiske biomarkører
De radiografiske biomarkører er parametre, som kan ses på et billede. Der findes mange forskellige apparater, som kan tage billeder af kroppen. Apparaterne kan visualisere forskellige dele af kroppen, alt efter hvad lægerne er interesserede i at undersøge. Et røntgenapparat kan tage billeder af kroppens knogler, men det kan også bruges til kræftundersøgelser f.eks. i lungerne. En CT-scanner virker lidt som et røntgenapparat, men den danner en helt masse tværsnit af kroppen for at få et mere detaljeret og tredimensionelt billede. Der findes også MR scannere, som kan lave billeder af kroppen ved brug af et kraftigt magnetfelt. De bruges ofte i forbindelse med sygdomme i hjernen. Derudover er der ultralydsscannere, som giver direkte transmitterede billeder af, hvad der sker i kroppen lige nu. De bruges for eksempel i forbindelse med graviditet og undersøgelse af fosteret.