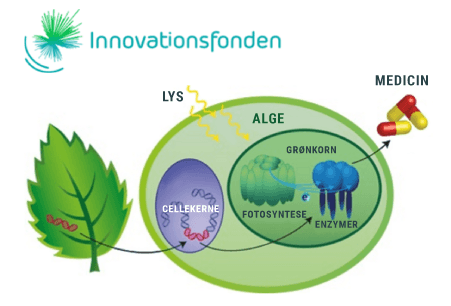
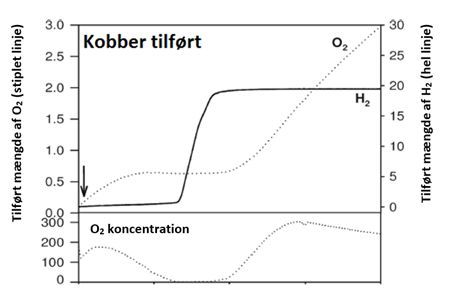
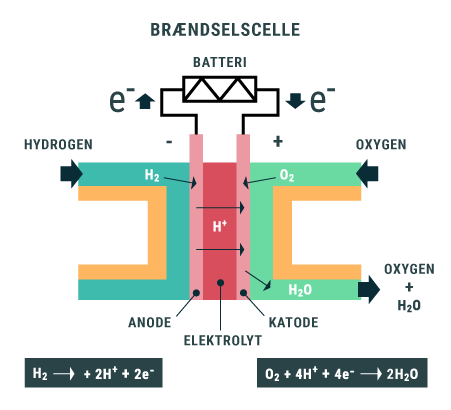
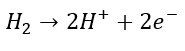Hvis vi kigger lidt nærmere på den overskudsenergi, som bliver dannet i fotosyntesen, vil vi opdage, at den bliver lagret i et protein, som kaldes ferredoxin (Fd). Fd fungerer som et batteri i algen, der optager al energien, der produceres i fotosyntesen fra sollyset. Det opladte batteri, kan nu bruges i de livsnødvendige reaktioner i algen, men der vil altid være noget overskudsenergi på batteriet, som algen ikke kan udnytte. Forskerne fra KU forsøger at overføre denne energi til en bestemt gruppe af enzymer, kaldet P450-enzymer. Disse enzymer laver meget vigtige reaktioner i planter, som eksempelvis produktionen af naturstoffer, som vi mennesker benytter i medicin, farvestoffer, kosmetik og meget andet. Et par velkendte eksempler på processer, hvor enzymer indgår, er ved produktionen af malariamedicinen artemisinin og kræftmedicinen taxol. Problemet er, at disse stoffer typisk bliver dannet i træer og planter, som er meget sjældne og/eller vokser utroligt langsomt. Derfor er det at foretrække, at kunne producere disse stoffer i alger, som vokser hurtigt, og hvor produktionen kan optimeres ved genetisk at ændre algerne. Problemet er, at stoffer som taxol og artemisinin, er så komplekse af producere, at der skal mange års yderlige forskning og en god portion held til før at det lykkes.
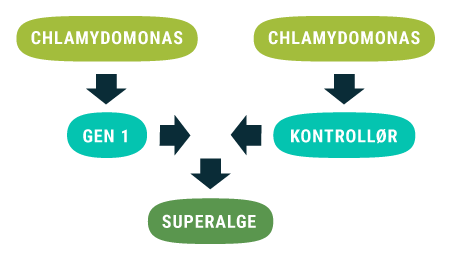
Forskerne fra KU gik i 2013 i gang med at undersøge, om konceptet virkede, og man kunne bruge overskudsenergi fra fotosyntesen til enzymreaktioner, som normalt optrådte i andre planter, i cyanobakterier i stedet ved genetisk modifikation. I 2015 udgav forskerne fra KU en videnskabelig artikel, som beskrev hvordan de havde indsat en bestemt reaktionsvej i en cyanobakterie. Reaktionsvejen består af en række gener fra en Durra plante, som laver stoffet dhurrin. De fik endda koblet denne reaktionsvej direkte på fotosyntesen. Det vil sige at den overskudsenergi, som bliver produceret i fotosyntesen i algen kunne bruges til at danne dhurrin. Dette var ved hjælp af enzymer, som normalt dannes i Durra planten.
En reaktionsvej består af en række kemiske reaktioner, der fører til produktionen af et bestemt stof, der foregår inde i en celle.
Dette forsøg har vist, at hvis man kender reaktionsvejen til et bestemt naturligt stof, som eksempelvis produceres i et træ, kan man faktisk finde frem til, hvilke gener der indgår i denne reaktionsvej. Disse gener kan man så overføre til en cyanobakterie, som vokser langt hurtigere end træet, og derfor kan lave en højere produktion af det naturlige stof. Reaktionsvejen kan nu kobles til fotosyntesens overskudsenergi, igennem det biologiske batteri ferredoxin, og udnytte energi fra sollyset til at producerer det naturlige stof. Konceptet er hermed blevet bevist af forskerne fra KU. Næste skridt er nu at producere nogle af de mest komplekse naturstoffer, som indgår i eksempelvis kræftmedicin, og dermed kunne redde mange menneskeliv i fremtiden.
Den hellige gral
Nu vil jeg fortælle dig en historie om den hellige gral inden for den medicinske verden; nemlig historien om kræftmedicinen Taxol.
Taxol tilhører terpener og er et af de mest effektive kræftmedikamenter, vi kender til i dag. Taxol er det stof, som enhver forsker inden for den medicinske verden, drømmer om at kunne producere i store mængder. I januar måned 2016 var prisen på en guldbarre på 12,4 kg = 3.048.726 kroner. Til sammenligning ville 12,4 kg taxol have kostet dig 137.432.920 kroner. Taxol er altså næsten 46 gange mere værd end guld. *
Hvorfor er dette vidundermiddel egentlig så dyrt?
Lad os kigge på, hvor Taxol bliver produceret naturligt. Paclitaxel, som Taxol oprindeligt hedder, blev opdaget i 1962, hvor man fandt ud af, at det kunne oprenses fra barken af et bestemt takstræ. Varemærket for den nye medicin blev senere navngivet Taxol. Træet vokser utroligt langsomt i naturen, og var allerede dengang ikke særlig udbredt. I dag er træet næsten udryddet. Først i 1971 havde forskerne slået fast, at Taxol kunne bruges i kræftmedicin. Hvis man skærer al barken af et takstræ står man tilbage med 2 kg bark. Der skal 12 kg bark til at producere 0,5 gram Taxol. Træet overlever ikke at miste barken, og man udryddede stort set alle træerne i verden i jagten på den nye kræftmedicin.
Hvordan virker Taxol i behandlingen af kræft?
Når man får kræft betyder det, at nogle bestemte celler i kroppen begynder at dele sig uhæmmet. Normalt sker celledeling i kroppen efter en nøjagtig procedure. De fleste af de fejl, der opstår i cellerne, vil blive rettet, så cellerne fungerer optimalt. Dette bliver sat ud af spil, når cellerne bliver til kræftceller. Kræftceller deler sig utrolig hurtigt, og de har alt for mange fejl. Dette gør os mere og mere syge.
Taxol virker ved at stimulerer nogle bestemte proteiner til at gå ind og sætte en stopper for den uhæmmede celledeling, og det kan på den måde forhindre kræften i at spredes til resten af kroppen. I 1992 blev Taxol godkendt som lægemiddel i USA, og det blev solgt som medicin imod brystkræft for 1000 dollars per dosis. Normalt skal man have 4-5 doser af medicinen, før brystkræften er behandlet, og det var på det tidspunkt det dyreste medikament i verden.
Taxol kan bruges til behandling af nogle af de hyppigst forekommende typer af kræft, og forskere forsøger fortsat at producere Taxol i forskellige produktionsorganismer. Lige nu er de mest lovende resultater fundet ved at bruge gærceller eller bakterien E. coli til at producere Taxol. Desværre har man dog kun indført dele af reaktionsvejen som fører til Taxol, og den dag i dag er det stadigvæk kun muligt at oprense Taxol fra barken fra takstræet. Taxols reaktionsvej er meget kompleks, og består af mange gener, man skal have indsat samtidig og få dem til at arbejde sammen i en helt ny organisme.
Produktionen af ”den hellige gral” ligger ude i fremtiden, men tænk hvis man kunne producere stoffer som Taxol i cyanobakterier i stor skala. Det er allerede lykkedes for forskerne på KU at lave en model over, hvordan man kan indsætte hele reaktionsveje ind i alger og få dem koblet direkte på fotosyntesen. Det kræver stadigvæk megen forskning og tusindvis af forsøg, før vi når til at kunne producere store mængder af Taxol i alger. Det ligger mere nærliggende, at forskerne snart vil opdage, hvordan man skal producere andre, mere simple, medikamenter og værdifulde stoffer i store mængder i alger.
*Find den aktuelle guldpris på her.
*Hvis du vil læse mere om den nyeste forskning inden for dette felt, kan du besøge Københavns Universitets hjemmeside.