Celler er omgivet af en cellemembran, der afgrænser cellens indre. Membranen er god til at regulere hvor mange molekyler der har lov til at passere både ind og ud af cellen. På den måde sørger cellemembranen for at der opretholdes tilpas koncentrationer af bestemte stoffer inde i cellen og har en essentiel funktion der understøtter cellens liv.
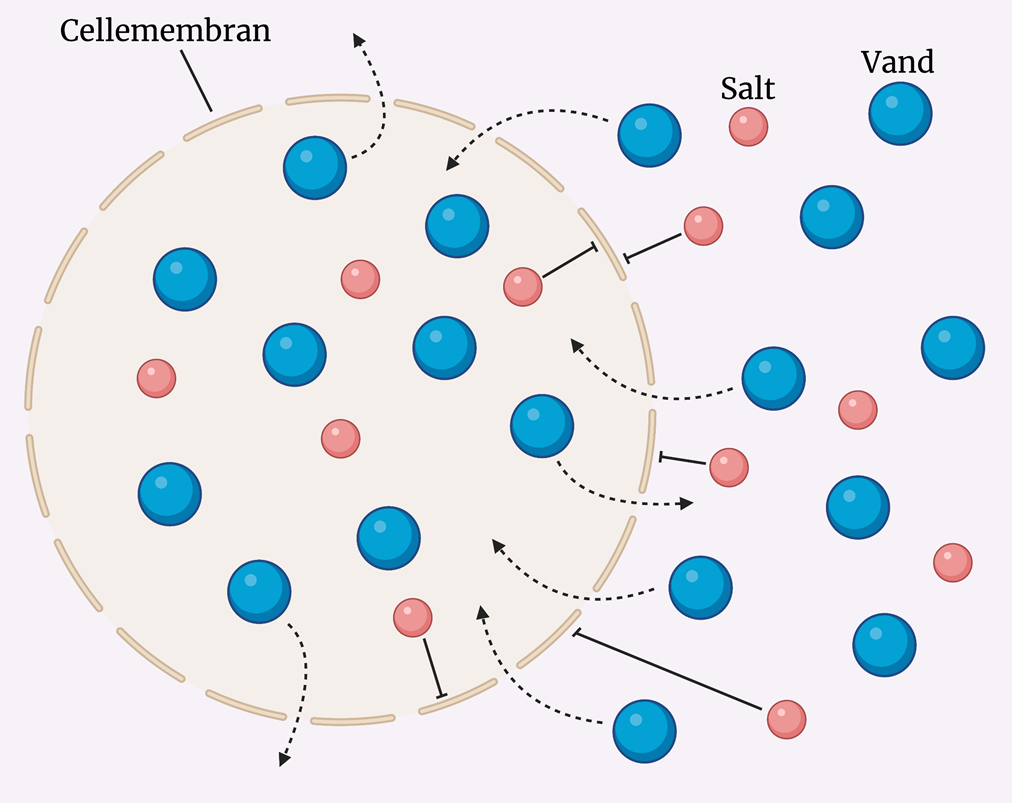
Gennem cellemembranen kan vand passere direkte ind og ud af cellen. Derimod tillader membranen ikke, at stoffer som salte og sukkerstoffer kan passere direkte igennem den. Figur 1 illustrerer, hvordan vand direkte kan bevæge sig gennem cellemembranen, mens salt ikke kan. Stoffer som salte og sukkerstoffer må i stedet benytte sig af kanalproteiner eller transportproteiner, når de skal gennem membranen.
Hvad er osmose?
Osmose er den proces, hvor vand bevæger sig fra høj til lav vandkoncentration på tværs af en membran. Gennem osmose forsøger cellen at skabe ligevægt ved at udligne en koncentrationsforskel. Når der er ligevægt, er der lige store koncentrationer på hver side af cellemembranen.
Tre slags saltopløsninger
Vand bevæger sig ind eller ud af cellen alt efter saltkoncentrationen på hver side af membranen. Der kan være tre slags saltopløsninger udenfor cellen:
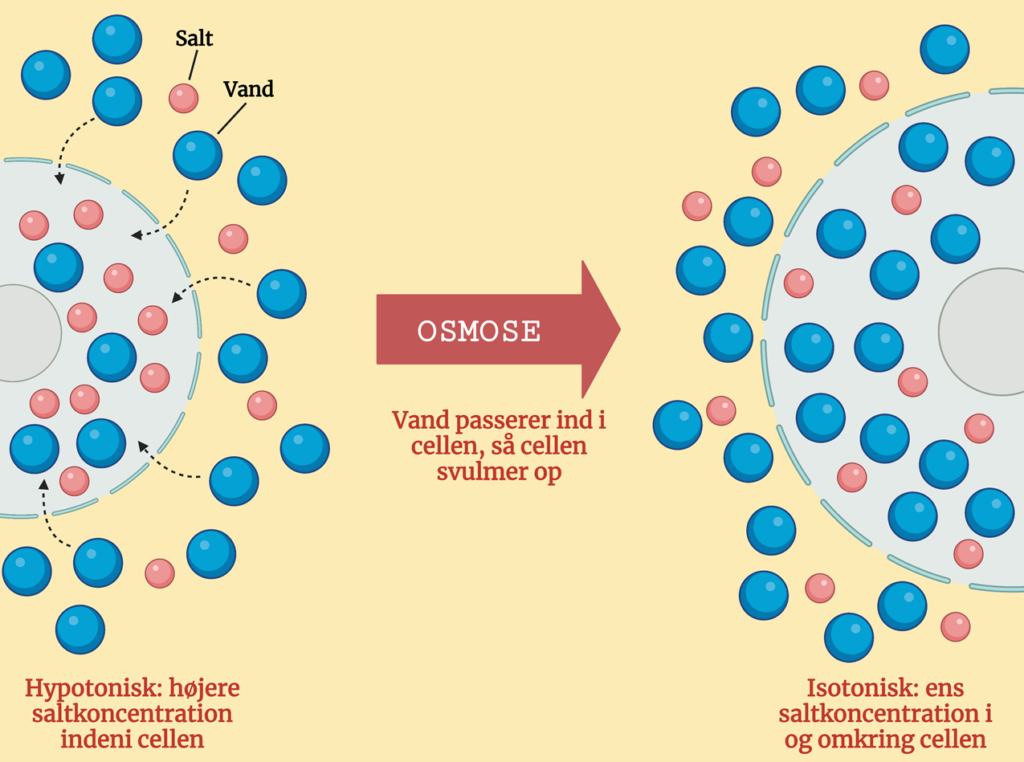
Hypotonisk saltopløsning: Der er en mindre saltkoncentration udenfor end indeni cellen. Gennem osmose føres vandet ind i cellen, til der opnås ligevægt. Cellen svulmer op, når den optager vandet. Denne effekt kan ses på Figur 2.
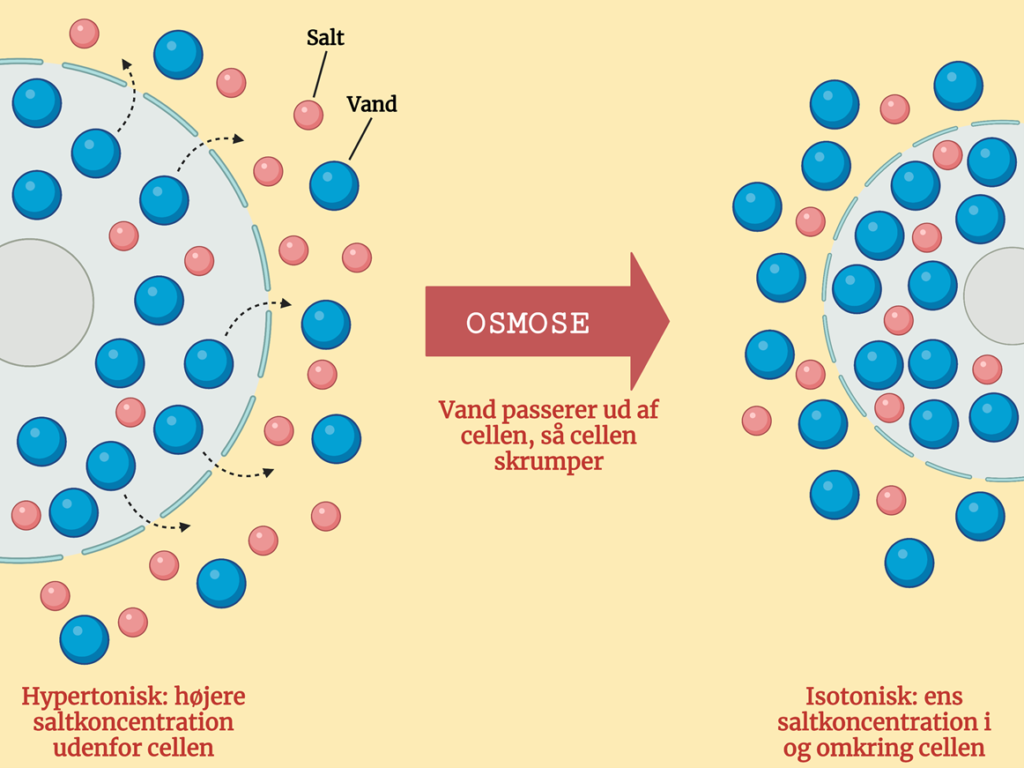
Hypertonisk saltopløsning: Der er en større saltkoncentration udenfor end inden i cellen. Via osmose bevæger vandet sig ud af cellen for at opnå ligevægt. Cellen skrumper, når vand bevæger sig ud af den. Dette kan du se på Figur 3.
Isotonisk opløsning: Saltkoncentrationen er lige stor på hver side af membranen – altså er der ligevægt. Der sker derfor en lige stor bevægelse af vand ind og ud af cellen.
Mange eukaryote celler, som cellerne i vores krop, foretrækker en saltkoncentration på 0,9%. Denne opløsning kaldes også for fysiologisk saltvand. I øjenskyl er der eksempelvis 0,9% salt i, så cellerne i øjet ikke irriteres. Ved højere saltkoncentrationer kan det svie i øjnene – det kender du måske fra badeferier sydpå?
Man skal heldigvis ikke selv tænke over at opretholde denne ligevægt. Hvis man eksempelvis får for meget salt gennem maden, signalerer cellerne til hjernen, at man har brug for vand, og så bliver man tørstig.
« Back to Glossary Index
