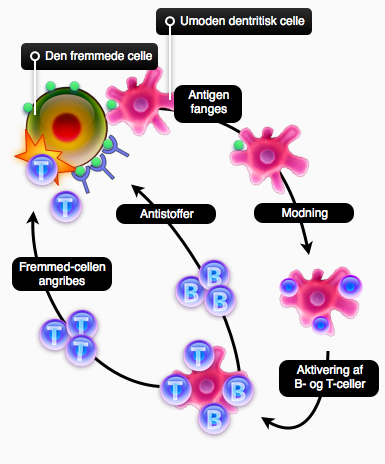
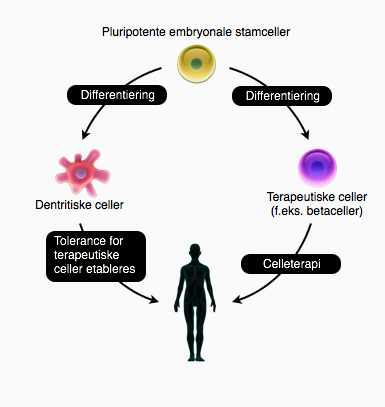
Det er samtidig meget vigtigt, at der forskes i flere forskellige metoder til at løse problemerne, da det oftest virker rigtig godt at lave kombinationsbehandlinger. Hvis det lykkes at få immunforsvaret til at acceptere transplanterede celler, har det vidtrækkende konsekvenser for behandlingen af en lang række sygdomme. Det er et problem, der skal løses, før celleterapi med stamceller kan udfolde sit fulde potentiale: Fuldstændigt at helbrede mennesker for sygdomme som kræft, AIDS, Parkinsons sygdom og sukkersyge.
Terapeutisk kloning og ”risikoen” for reproduktiv kloning
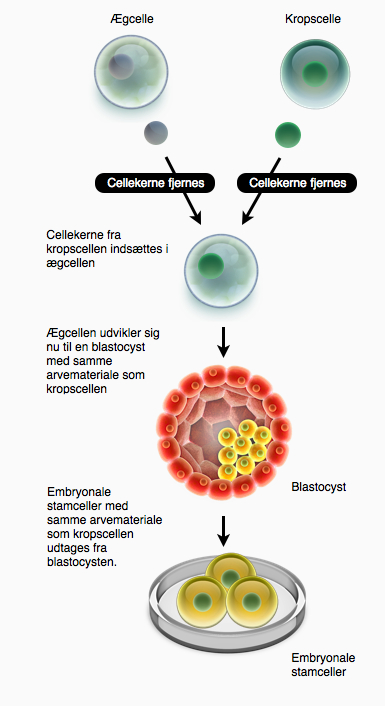
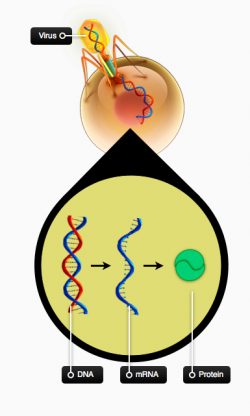
I de seneste år, har terapeutisk kloning været et meget debatteret emne. Teknikken har blandt andet været anvendt til at klone fåret Dolly. Terapeutisk kloning virker ved, at en cellekerne fra en hvilken som helst celle (f.eks. en hudcelle) fra en patient overføres til et ubefrugtet æg, der har fået fjernet sin egen kerne. Ægget, der nu tror at det er befrugtet, indeholder arvemateriale fra patienten, som donerede kernen. Hvis dette æg indsættes i en livmoder, vil det kunne udvikles til en klon af patienten, hvilket var tilfældet med fåret Dolly (reproduktiv kloning). Det er dog ikke officielt blevet forsøgt på mennesker, da det af etiske årsager er forbudt at klone mennesker.
Idéen med terapeutisk kloning er at lade det dannede ’befrugtede æg’ udvikle sig til blastocyststadiet, hvorfra der isoleres embryonale stamceller. Stamcellerne har samme stregkode som patientens egne celler. Cellerne afstødes derfor ikke af patientens immunforsvar. Hvis disse stamceller differentieres til terapeutiske celler, kan de transplanteres til patienten, uden at afstødes.
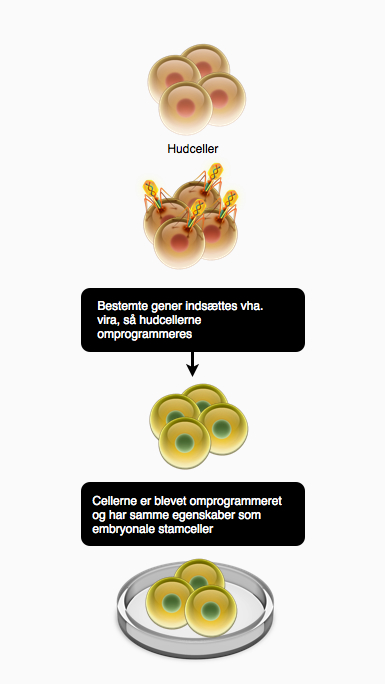
Der er flere faktorer, der gør terapeutisk kloning problematisk. For det første skal der bruges ét ubefrugtet æg pr. behandling. Det er et stort indgreb at udtage æg fra en kvinde, da det involverer en kraftig hormonbehandling og en ikke ufarlig operation. Samtidig er der store etiske problemer ved metoden. Det kernetransplanterede æg har jo muligheden for at udvikle sig til et barn, som er en klon af patienten, hvilket i høj grad kan misbruges. Af disse årsager er der en stor chance for, at terapeutisk kloning vil blive udkonkurreret af såkaldte inducerede pluripotente stamceller, som beskrives her.