Differentiering af stamceller
I denne artikel beskrives, hvilke forskellige typer stamceller der findes, og hvilke egenskaber de har. Det beskrives herefter, hvordan forskerne bruger gensplejsning, virus og selvlysende mus, til at finde frem til de signalproteiner, der kan lave stamceller om til forskellige terapeutiske celler. Til sidst forklares, hvordan forskerne dyrker stamceller og forsøger at differentiere stamceller til terapeutiske celler i laboratoriet.
Forskellige typer stamceller
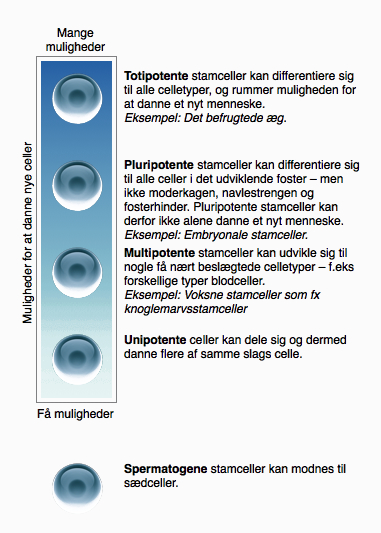
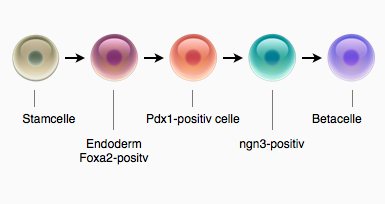
Stamceller er uspecialiserede celler, der har evnen til at udvikle sig til mange andre celler. Ud over embryonale stamceller, der blev beskrevet i den foregående artikel, findes der voksne stamceller. Hvor embryonale stamceller kan udvikle sig til alle kroppens celler, kan voksne stamceller kun udvikle sig til nogle få nært beslægtede celletyper.
Nedenfor er en beskrivelse af forskellige typer stamceller, opdelt efter hvor stort et antal nye celletyper de har mulighed for at udvikle sig til.
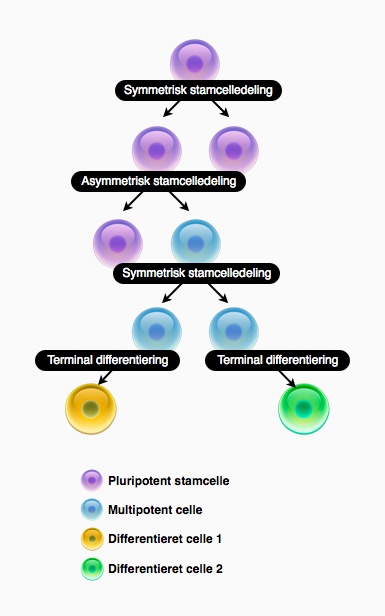
Hvordan virker en stamcelle?
Når en stamcelle deler sig, kan det ske på flere måder. Ved en symmetrisk celledeling deles stamcellen til to nye stamceller. Dette kan gøres i laboratoriet, og det er derfor muligt at lave så mange stamceller, som der ønskes.