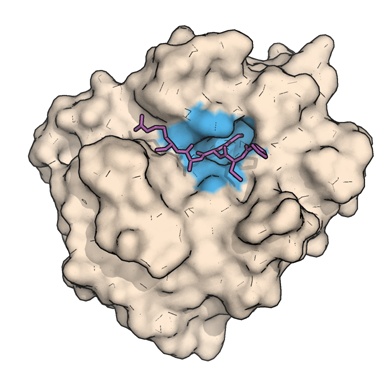
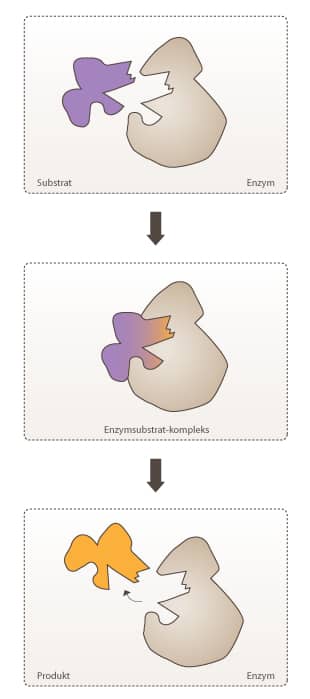
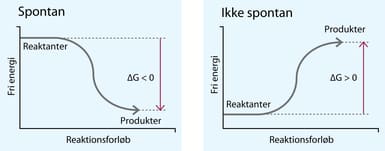
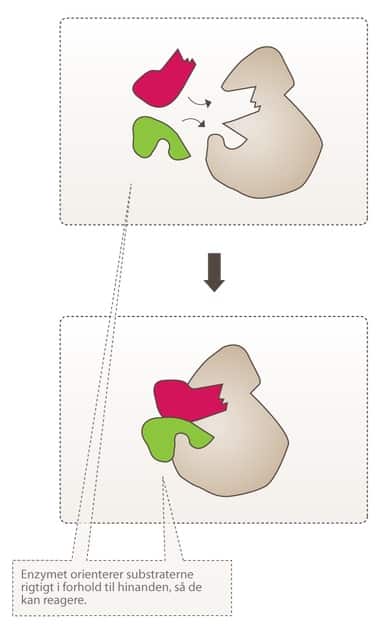
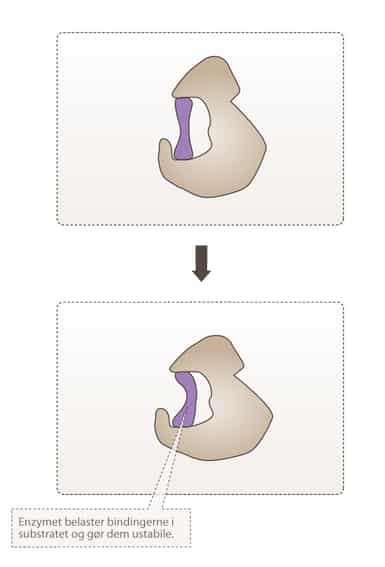
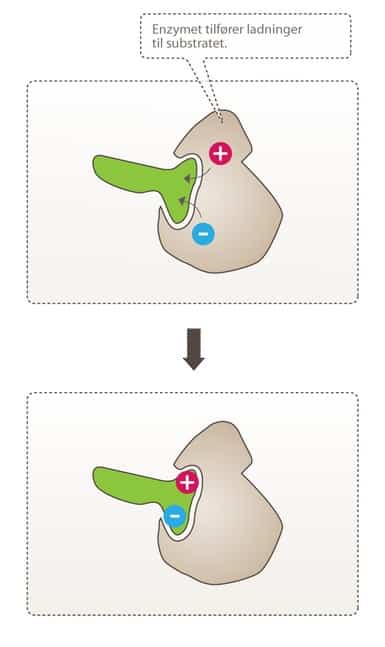
Et substrat (S) bindes til et enzym (E) og danner et ES-kompleks (ES). Dette sker med hastighedskonstanten k1:
Reaktion 2:
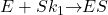
Nu kan der så ske én af to ting. Enten vil enzymet og substrat gå fra hinanden igen (dissocieres) – dette vil ske med hastighedskonstanten k-1:
Reaktion 3:
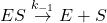
Eller også vil reaktionen fortsætte, og der vil dannes produkt (P) med hastighedskonstanten k2:
Reaktion 4:
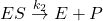
Reaktion 2, 3 og 4 er opsummeret i reaktion 1. Idet reaktion 2 og 3 er hinandens modsætninger, er disse skrevet med en ligevægtspil i reaktion 1.
Dannelsen af ES-komplekset (reaktion 2) sker som regel hurtigt, hvorimod selve dannelsen af produkt (reaktion 4) er langsommere, og derfor kaldes dette det hastighedsbestemmende trin.
Modellen herover er den simpleste model, der gør rede for de kinetiske karakteristika af de fleste enzymkatalyserede reaktioner. Den kaldes Michaelis-Menten modellen opkaldt efter tyskeren Leonor Michaelis og canadieren Maud Menten, der fremsatte den i 1913. Det særlige ved denne model er, at ES-komplekset fungerer som et intermediat i reaktionen.
Michaelis-Menten ligningen
Ud fra Michaelis-Menten modellen og en antagelse om, at koncentrationen af ES-kompleks er konstant, kan man opskrive et matematisk udtryk, der beskriver, hvordan hastigheden af reaktionen – dvs. omdannelsen af substrat til produkt, afhænger af koncentrationerne af substrat og enzym samt af hastighedskonstanterne i de forskellige trin i reaktionen.
Dette udtryk kaldes Michaelis-Menten ligningen, og ser ud som følger:
Ligning 1:
![Rendered by QuickLaTeX.com v_0 = V_{max}\cdot\frac{[S]}{[S]+K_M}](https://www.biotechacademy.dk/wp-content/ql-cache/quicklatex.com-8ebba14e977865a1194dac82026f0a32_l3.png)
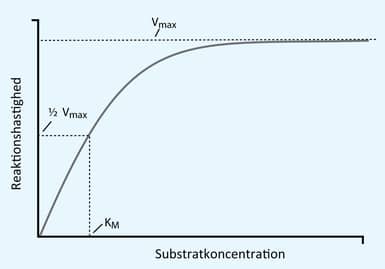
Michaelis-Menten ligning beskriver initialhastigheden hvormed enzymet arbejder, V0, som en funktion af substratkoncentrationen, [S]. Jo mere substrat der er til stede, des højere vil initialhastigheden være.
Derudover indgår to parametre: Michaelis-Menten konstanten, KM er givet som:
Ligning 2:
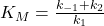
Og Vmax, den maximale hastighed der kan nås med den gældende mængde af enzymer til stede:
Ligning 3:
![Rendered by QuickLaTeX.com V_{max}=k_{cat}\cdot[E]_0](https://www.biotechacademy.dk/wp-content/ql-cache/quicklatex.com-180a315c03ac437b8fd70737a9a80a92_l3.png)
Hvor kcat er det samme som k2, og [E]0 er enzymkoncentrationen til stede, når substratet tilsættes.
Vmax er den enzymaktivitet der nås, når samtlige aktive sites, på alle enzymer, er bundet til substrat.
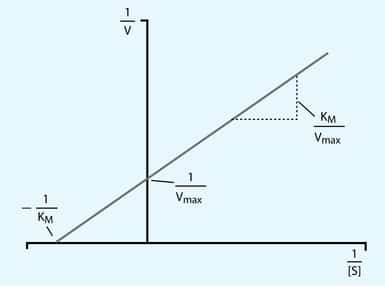
De to parametre, sammen med kcat, bruges til at beskrive hvordan et enzym opfører sig. KM beskriver enzymets affinitet for substratet. Mere præcist, så er KM den substratkoncentration, hvor V0 = ½ Vmax (se figur 15 og nedenstående afsnit). Dette afspejler hvor effektivt substratet kan binde til enzymet. Hvis KM -værdien er lav, så har enzymet og substratet en høj affinitet, da meget lidt substrat skal til for at mætte enzymerne. Tilsvarende afspejler kcat og Vmax hvor effektivt ES-komplekset er til at omdanne substratet til produkt. En høj kcat indikerer at enzymet på meget kort tid omdanner substrat til produkt.
En detaljeret udledning af Michaelis-Menten ligningen er beskrevet i Biotech Academy projektet “Alkohol og stoffer”, i teoriafsnittet “Alkohols nedbrydning i kroppen”.