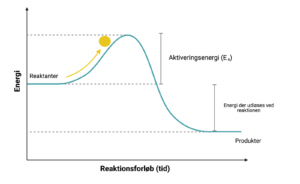
Aktiveringsenergi (Ea) er det energiinput, der kræves, for at få en kemisk reaktion til at forløbe. Det er altså den minimumsmængde af energi, der skal være til stede i reaktanterne, for at reaktionen kan forløbe.
Man kan betragte det som det skub der skal tilføres en kugle for at den kan komme op ad bakke, for derefter at trille ned igen. Skubbet svarer til den mængde af energi der tilføres reaktionen. Energien for produkterne er lavere end den for reaktanterne, så den samlede mængde af energien reduceres under reaktionsforløbet. Der udløses derved energi ved reaktionen. Derfor triller kuglen ned af bakke, efter den har opnået en energi på Ea.
I praksis kan man tilføre energi til en reaktion ved at varme reaktionen op. Varmen øger den kinetiske energi for reaktanterne, sandsynligheden for sammenstød mellem dem øges, og de reagerer derfor hurtigere med hinanden.
Aktiveringsenergien er forskellig fra reaktion til reaktion, da nogle reaktanter kræver mere energi for at reagere med hinanden end andre.
Aktiveringsenergi i biokemiske reaktioner
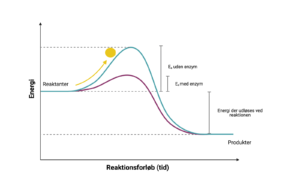
Enzymer sænker aktiveringsenergien for biokemiske reaktioner. Dette skyldes at enzymet orienterer substrater, så der lettere opstår en binding mellem dem. Det kræver mere energi hvis substraterne tilfældigt skal støde sammen på den helt rigtige måde.
Biokemiske reaktioner i vores krop foregår ved kropstemperatur, og kan naturligvis ikke opvarmes. Enzymer er her afgørende for at stoffer kan omdannes i cellerne. Mange biokemiske reaktioner i vores kroppe ville tage mange tusinde år, hvis de skulle forløbe uden tilstedeværelsen af enzymer. Derfor kalder man enzymer biologiske katalysatorer.