Det aktive site, også kaldet det aktive center, er det sted på/i et enzym et eller flere substrater bindes, og den biokemiske reaktion forløber. Her er et antal af aminosyrer ansvarlige for midlertidigt at binde til substratet, og katalysere den biokemiske reaktion. I nogle enzymer ligger det aktive center dybt inde i enzymet, hvor for andre ligger det på overfladen.
Man kan opdele det aktive site i to dele; en bindingsdel og en katalytisk del. Bindingsdelen består af et antal aminosyresidegrupper, hvis formål er at binde til et eller flere substrater. Den katalytiske del, er der hvor reaktionen sker. Det er typisk et mindre antal af aminosyrer, der befinder sig i den katalytiske del. I denne del er der katalytiske grupper i aminosyrerne, der indgår i reaktionen som enzymet katalyserer. Disse grupper er funktionelle gruppe, der tager del i reaktionsmekanismen, og enten bryder eller danner bindinger i det substrat enzymet binder.
Enzymer binder til substrater med induced fit
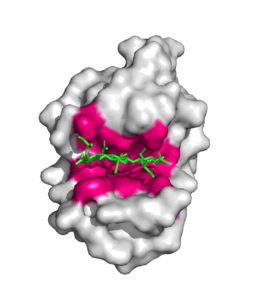
Enzymer er meget specifikke, hvilket vil sige, at de kun binder til et bestemt substrat og kun udfører én bestemt biokemisk reaktion. Denne specificitet afgøres ud fra dets tredimensionelle struktur og dets aktive site. Et aktivt site og substratet passer derfor til hinanden, ved at deres sidegrupper har modsatte ladninger, indeholder hydrofobiske dele, og/eller at sidekæderne ikke støder sammen (se figur 1).
Enzymet og substratet tilpasser sig hinanden, når et substrat bindes. Dette kaldes induced fit. Bindingen af enzym og substrat til hinanden er derfor lidt mere kompliceret, end at de passer sammen som i en nøgle i en lås.
Ved induced fit ændrer både enzym og substrat sig strukturelt og sidegrupperne orienteres således, at enzym og substrat kan bindes til hinanden. Enzymet orienterer også substratet således at de funktionelle grupper i molekylet, der skal reagere, ligger optimalt ift. hinanden. At enzymet gør dette, er med til at sænke aktiveringsenergien(link til wiki) for reaktionen.
Der er fire typer af bindinger mellem substrat og enzym der er vigtige; Londonbindinger / Van der Waals bindinger, hydrofobiske interaktioner, hydrogen bindinger og interaktioner mellem ioner. Samtidigt er denne binding ikke alt for stærk, hvilket sikrer, at produkterne også kan frigives igen. Ladninger i substratet og det aktive site er komplimentære og udligner derved hinanden (se figur 2).
Induced fit mekanismen sørger også for at ekskludere H2O fra det aktive site, hvis reaktionen kræver at der ikke er vand til stede. Hvis et aktivt site er lokaliseret dybt inde i et enzym, har lokationen typisk til formål at forhindre H2O i at være til stede.
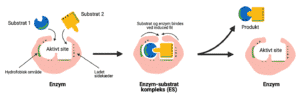
Figur 2: Det aktive sites kemiske miljø passer til de substrater det binder til. Det aktive site i enzymet sørger også for at orientere substraterne så de kan reagere med hinanden og danne produktet.
« Back to Glossary Index
