Amylaser og deres effekt
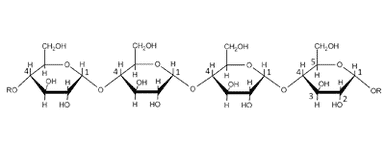
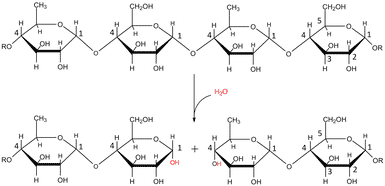
Amylaser er enzymer, der hydrolyserer glykosidbindinger i polysakkarider som f.eks. stivelse (Fig. 20). Amylaser er hydrolaser. De findes overalt i naturen bl.a. i spyt, og vil ligesom alle enzymer have forskellige egenskaber som f.eks. pH- og temperaturoptimum alt efter, hvor de kommer fra. I forbindelse med brødproduktion er α- og β-amylase de to mest anvendte amylaser.
α- og β-amylase
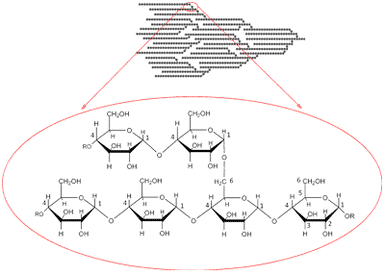
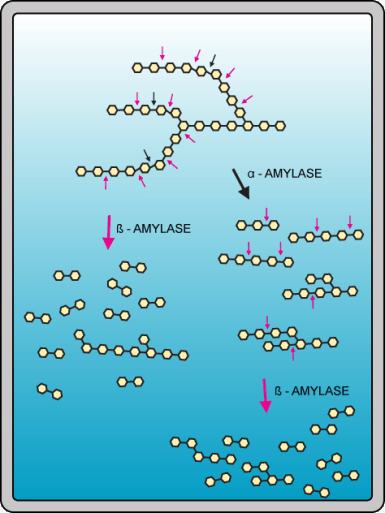
α- og β-amylase nedbryder begge stivelse til mindre molekyler og har således samme substrat, men de to enzymer virker ikke ens. α-amylase er en endoamylase og hydrolyserer α-(1,4)-glykosidbindinger inde i stivelsesmolekylet, mens β-amylase er en exoamylase, der hydrolyserer α-(1,4)-glykosidbindinger fra den ikke-reducerende ende af stivelsemolekylet. Det betyder, at α-amylase mere eller mindre tilfældigt klipper de lange stivelsesmolekyler i mindre stykker af varierende længde, hvorimod β-amylase frigør to sammenhængende glukosemolekyler (maltose) ad gangen. Forskellen mellem de to amylaser er illustreret vha. nedbrydelsen af amylopektin i Figur 21.
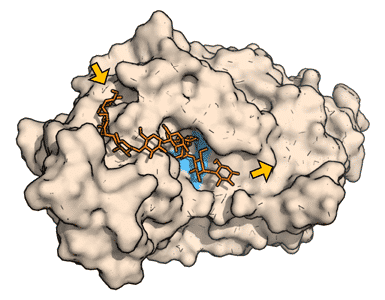
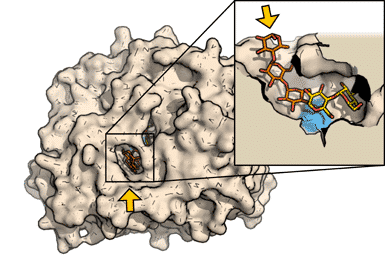
De to enzymer har samme substrat, men det er deres tredimensionelle struktur, der afgør, hvor og hvordan de bindes til stivelsesmolekylerne og dermed hvilke bindinger, de kan hydrolysere. Se Figur 22 og Figur 23.
Figur 22. Den tredimensionelle struktur af α-amylase. Det aktive center, hvor α-amylasen hydrolyserer α-(1,4)-glykosidbindingen, er markeret med blåt. De gule pile indikerer, at stivelsesmolekylet fortsætter.