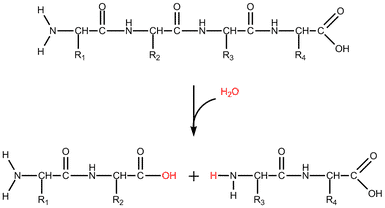
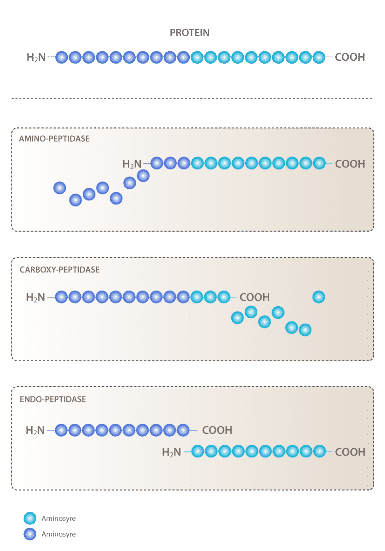
Gluten og proteaser
Proteindelen i mel er lille sammenlignet med mængden af stivelse. Den udgør 10-14 %, hvor mængden af stivelse udgør 80-85 %. Ikke desto mindre er det proteindelen, der er ansvarlig for dannelsen af et unikt viskøst og elastisk proteinnetværk kaldt gluten. Dette proteinnetværk er specielt for hvedemel. Gluten dannes, når melet indeholdende de to proteintyper gliadin og glutenin blandes med vand, og dejen æltes.
Gliadiner og gluteniner
Gliadiner er globulære og symmetriske proteiner. Gluteniner er store og langstrakte komplekser af flere forskellige proteiner, og har derfor et langt større overfladeareal (Fig. 24). Både gliadiner og gluteniner indeholder svovlbroer(disulfidbindinger). I gliadiner er de primært intramolekylære, mens gluteniner indeholder både intra- og intermolekylære svovlbroer.
Begge proteintyper er uopløselige i vand og har et højt indhold af aminosyrerne glutamin og prolin. I modsætning til mange andre proteiner er der kun en meget lille del af de to glutenproteiners sekundære struktur, der har α-helixkonformation. Dette skyldes sandsynligvis den høje koncentration af prolin og denne aminosyres særlige konfiguration.