Enzyminhibering: Medicinsk brug af alkohol
Denne underside udgør fjerde del af teorien for Biotech Academys materiale om Alkohol og enzymkinetik.
I “Enzymatisk nedbrydning af alkohol” blev det beskrevet, hvordan alkohol nedbrydes i den menneskelige krop, når vi indtager det. Det viser sig, at viden om ethanols nedbrydning ved hjælp af enzymet alkoholdehydrogenase kan være yderst brugbar, når man skal behandle forgiftninger forårsaget af andre alkoholer, ofte methanol/træsprit. Det princip, der her udnyttes, kaldes inhibering. Princippet vil blive beskrevet nedenfor.
Enzyminhibering
Enzymers aktivitet er ikke nødvendigvis konstant og kan derfor godt blive påvirket af andre kemiske stoffer. Et eksempel er, når et fremmed molekyle kommer ind i processen og på den ene eller anden måde nedsætter enzymets aktivitet. Et sådant molekyle kaldes en enzyminhibitor. Nedsat aktivitet vil for enzymets vedkommende sige, at reaktionen med et substrat enten forløber langsommere, eller at der skal større koncentrationer af substrat til for at få reaktionen til at forløbe. Enzyminhibitorer findes naturligt i kroppen og cellerne bruger dem til at regulere forløbet af forskellige reaktioner og kredsløb i kroppen. Rigtig mange medicinalprodukter fungerer desuden som inhibitorer over for forskellige enzymer. Et eksempel er ritonavir, der sælges under navnet Norvir. Ritonavir bruges til at behandle HIV/AIDS-patienter, idet det fungerer som inhibitor over for enzymet HIV-protease, der er vitalt for virussets livscyklus.
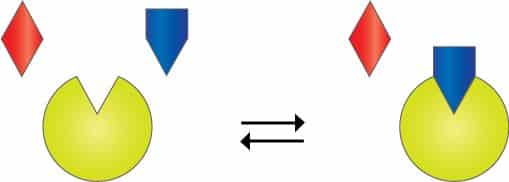
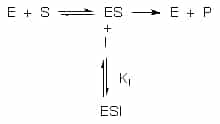
Der findes overordnet to typer enzyminhibitorer – reversible og irreversible. Forskellen på de to er, at de irreversible inhibitorer reagerer direkte med enzymet og derved omdanner det, mens de reversible blot indgår i et kompleks med enzymet, substratet eller begge. Irreversible inhibitorer deaktiverer således enzymet permanent, i modsætning til de reversible.
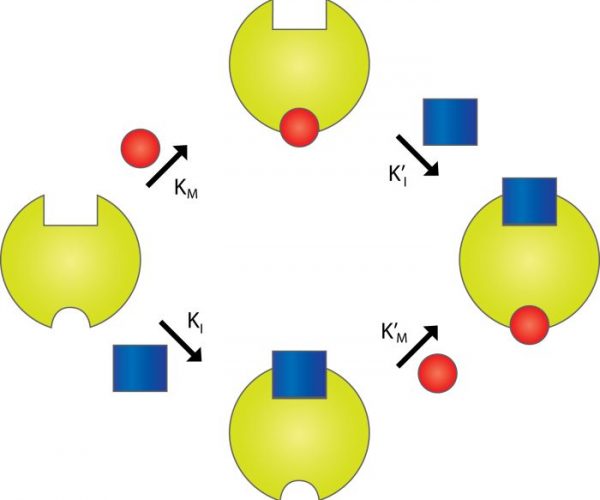
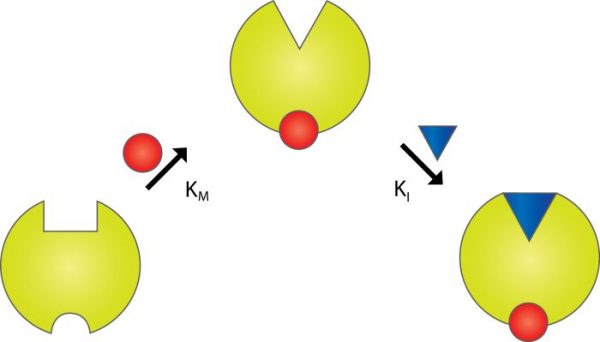
I denne artikel er det kun reversibel inhibering, der vil blive behandlet. Man taler normalt om tre typer reversible enzyminhibitorer: kompetitive inhibitorer, unkompetitive inhibitorer og nonkompetitive inhibitorer.