Enzymatisk nedbrydning af alkohol
Denne underside udgør tredje del af teorien for Biotech Academys materiale om Alkohol og enzymkinetik.
Når alkohol optages i kroppen, kan den ikke uden videre udskilles i samme form igen. Den skal nedbrydes til forskellige dele, der derefter kan behandles og udskilles af kroppen. Denne nedbrydningsproces forløber ikke af sig selv, men skal sættes i gang – man siger, at den skal katalyseres. En katalysator for en reaktion i kroppen vil oftest være et enzym, i dette tilfælde de to enzymer alkoholdehydrogenase og aldehyddehydrogenase. For at forstå alkohols nedbrydning i kroppen er det derfor nødvendigt at kigge nærmere på, hvad enzymer er, samt på hvordan de virker.
Hvad er et enzym?
Enzymer er en fællesbetegnelse for proteiner, der fungerer som katalysatorer for kemiske reaktioner. Det vil sige at de forøger reaktionshastigheden uden selv at blive forbrugt. En katalyseret reaktion kan forløbe flere millioner gange hurtigere end den samme ikke-katalyserede reaktion.
Hvis to reaktanter er til stede uden et enzym til at katalysere reaktionen mellem dem vil reaktionen ofte ske med så lav en hastighed at den i praksis vil være ubetydelig. Enzymer spiller derfor en vigtig rolle i hele den menneskelige krop, idet de bestemmer hvilke reaktioner der vil forløbe med en nævneværdig hastighed. En yderligere vigtig egenskab ved enzymer er deres specifitet. Et givent enzym er kun i stand til at katalysere bestemte reaktioner under meget specifikke betingelser, hvilket er en vigtig egenskab og yderst brugbart i kroppen.
En del enzymer katalyserer ikke reaktioner uden tilstedeværelsen af et yderligere ’hjælpemiddel’, kaldt en cofaktor. En cofaktor kan enten være et metal eller et lille organisk molekyle, kaldt et coenzym. Cofaktorer hjælper enzymet med at katalysere en given reaktion og er således også med til at bestemme, hvilke reaktioner der forløber. Dette er blandt andet på grund af, at coenzymer kan være bærere af forskellige kemiske grupper, og derfor udgør de en transportvej for nogle molekyler. I denne artikel vil der blive set nærmere på de to coenzymer NADH og NAD+.
Hvordan virker et enzym?
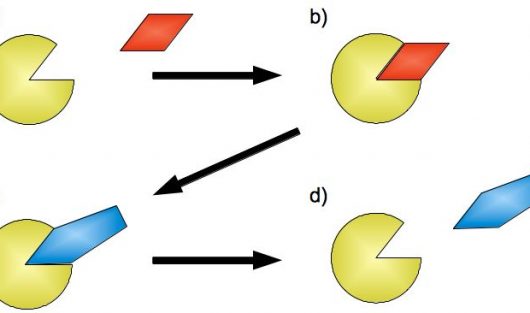
Der er stor forskel på enzymer og deres funktioner, men man kan overordnet forklare enzymers generelle funktion ud fra figur 4. Et enzym (E) og et substrat (S) mødes og danner de et kompleks (ES), hvorefter en kemisk reaktion forløber. Når reaktionen er løbet til ende er substratet forbrugt, og tilbage er enzymet samt en mængde produkt (P). Enzymet bevarer sin oprindelige form og struktur og kan katalysere en ny reaktion. Enzymet bliver altså ikke forbrugt under reaktionen.