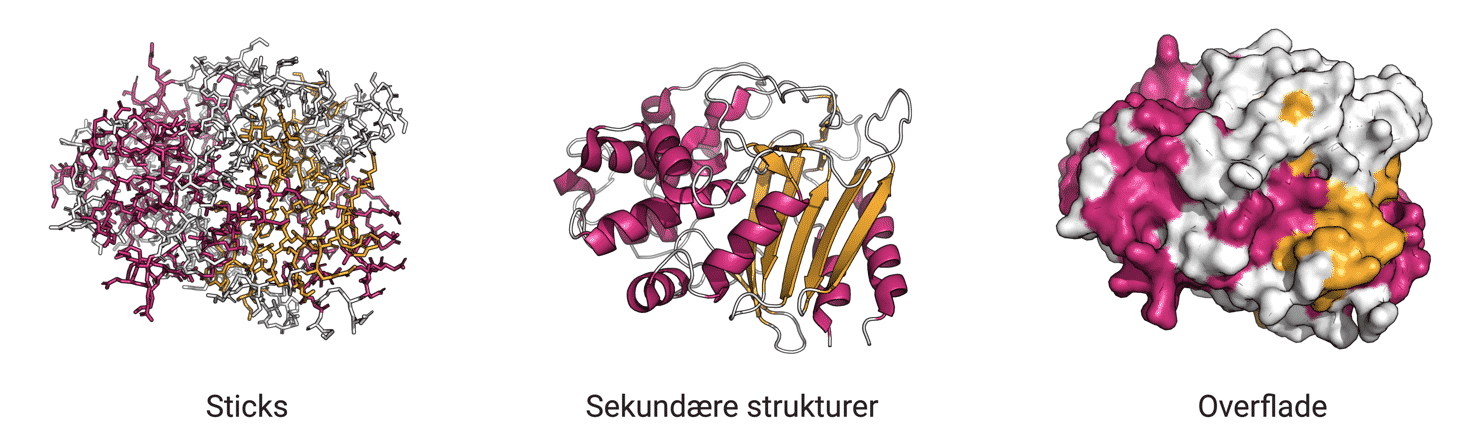
Enzymer
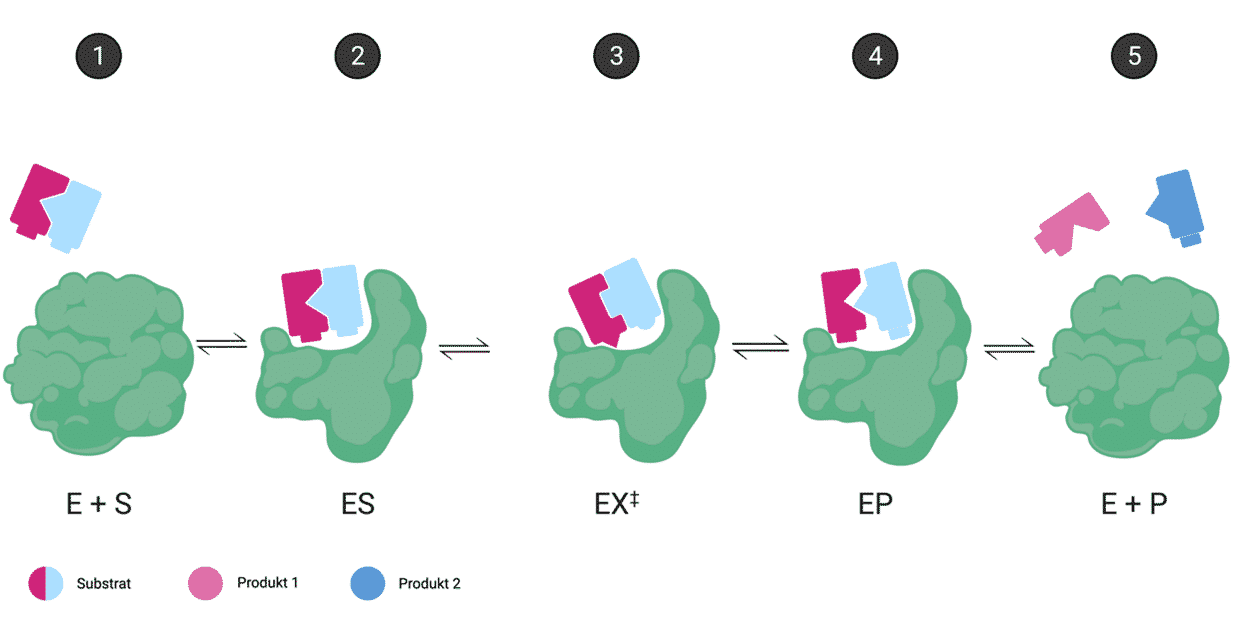
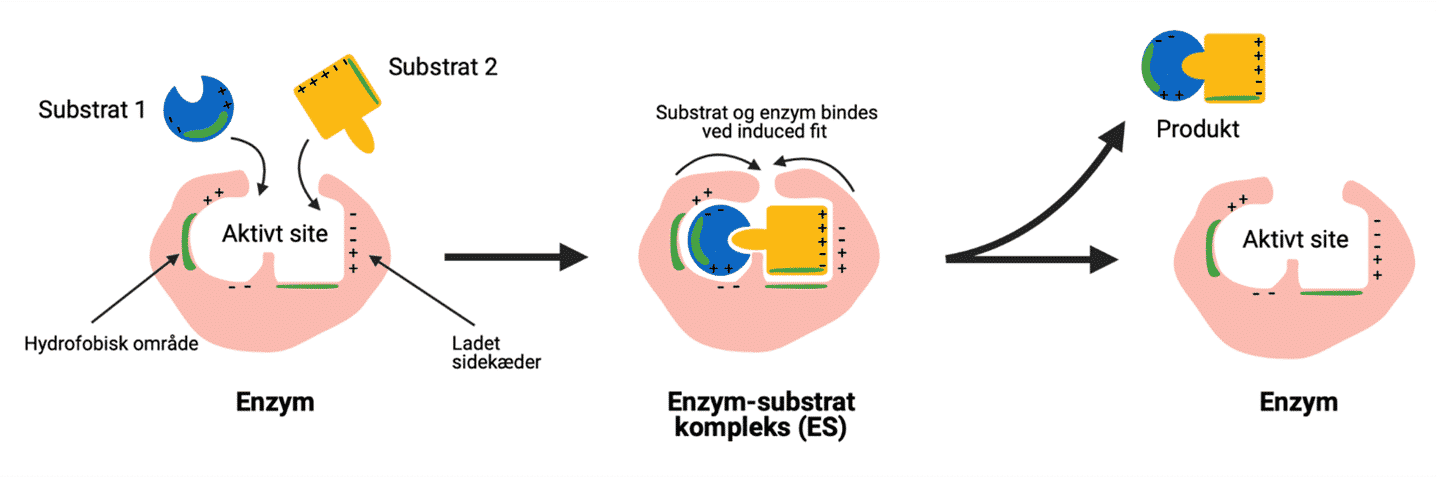
Enzymer er biologiske katalysatorer og katalyserer derfor biokemiske processer i levende organismer. De kan dog også fungere ekstracellulært – altså uden for cellen eller organismen. En katalysator øger reaktionshastigheden for en kemisk reaktion uden selv at blive omdannet og uden at ændre den kemiske ligevægt. Enzymer fungerer som katalysatorer ved at danne et fysisk og kemisk miljø, der fremmer, at den givne reaktion kan forløbe. Dette gør de ved at binde til substrater og derved øge den lokale koncentration af substrater såvel som at have reaktive funktionelle grupper, der kan deltage i reaktionen. Enzymer sænker derved aktiveringsenergien og øger reaktionshastigheden for biokemiske reaktioner. Af den grund er enzymer essentielle for alt liv på Jorden. De katalyserer reaktioner i cellers metabolisme, der ellers ville være for langsomme – helt op til millioner af år – hvis de skulle forløbe uden enzymers tilstedeværelse.
De to vigtigste pointer når det kommer til enzymers struktur og funktion er:
- Enzymer binder til deres substrat med høj affinitet og specificitet.
- Når substratet binder sig til det aktive site, forsager det strukturelle ændringer i enzymet.
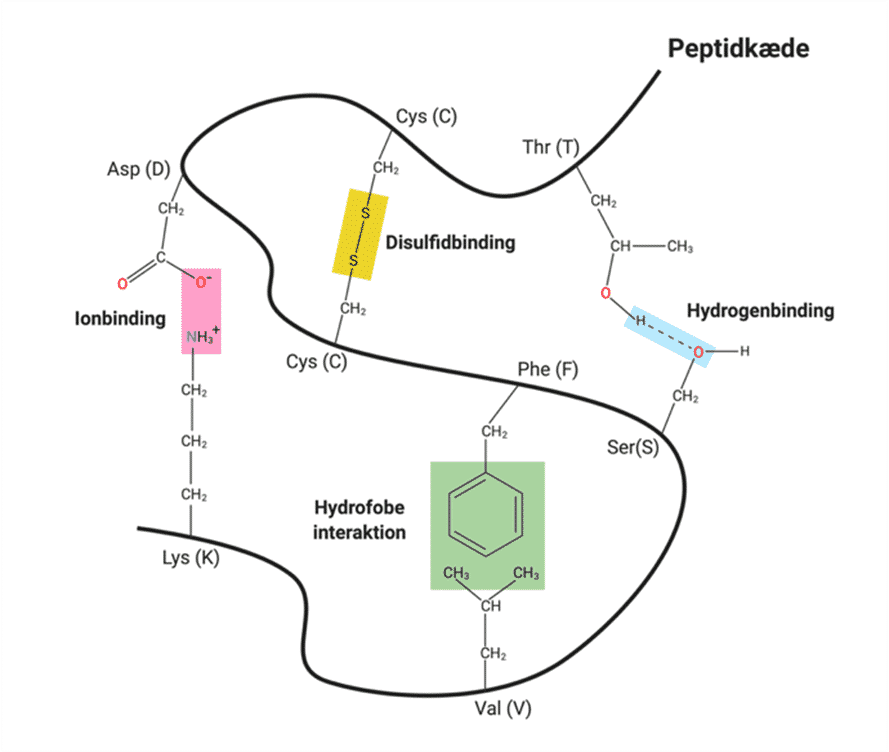
Når et substrat bindes, vil der ske en ændring i de intermolekylære bindinger i enzymet. Disse ændringer i strukturen fremmer, at produktet af reaktionen kan dannes. Selvom nogle ændringer forsager større ændringer i hele enzymet, foregår de fleste i eller omkring det aktive site.
De forskellige hovedklasser af enzymer
De fleste proteiner, hvis funktion er at være enzymer, har endelsen -ase. Udover endelsen er substratet, eller en beskrivelse af den biokemiske funktion enzymet udfører, oftest inkluderet i navnet. F.eks. har hydrolasen, peptidase, dets navn, da den bryder peptidbindingerne i proteiner ved hydrolyse.
Enzymer klassificeres i et system efter 6 typer af enzymatiske reaktioner, som enzymer katalyserer, og de hedder derfor således: oxidoreduktaser, transferaser, hydrolaser, lyaser, isomeraser, og ligaser. Til disse 6 hovedklasser er der mange underklasser til dem hver. I dette undervisningsmateriale vil vi fokusere på hydrolaser, som er yderligere opdelt i underklasser efter hvilken type binding de bryder, og dernæst efter deres type af substrat. I tabel 1 er vist en oversigt over hovedklasserne af enzymer.
Tabel 1:
| Enzymklasse | Reaktion |
|---|---|
| Oxidoreduktaser | Oxiderer og reducerer molekyler ved at det afgives eller optages elektroner. Reaktionen kaldes oxidations reaktion. |
| Transferaser | Flytter funktionelle grupper fra et molekyle til et andet, dette kan f.eks. være methylgrupper eller aminogrupper |
| Hydrolaser | Bryder bindinger i et substrat, hvorved der dannes to produkter ved optagelse af et mindre molekyle, hvilket oftest er vand. Reaktionen kaldes hydrolyse. |
| Lyaser | Spalter C-C, C-O, C-N og andre bindinger ved anden måde end hydrolyse eller oxidation. |
| Isomeraser | Intramolekylær omrokering flytter funktionelle grupper i et molekyle |
| Ligaser | Danner C-C, C-O, C-N, eller C-S bindinger ved brug af ATP |
Strukturen af proteiner og de 20 aminosyrer
Det er vigtigt først at forstå strukturen af proteiner, hvis man vil vide, hvordan enzymers struktur relaterer til deres funktion og katalytiske mekanisme.
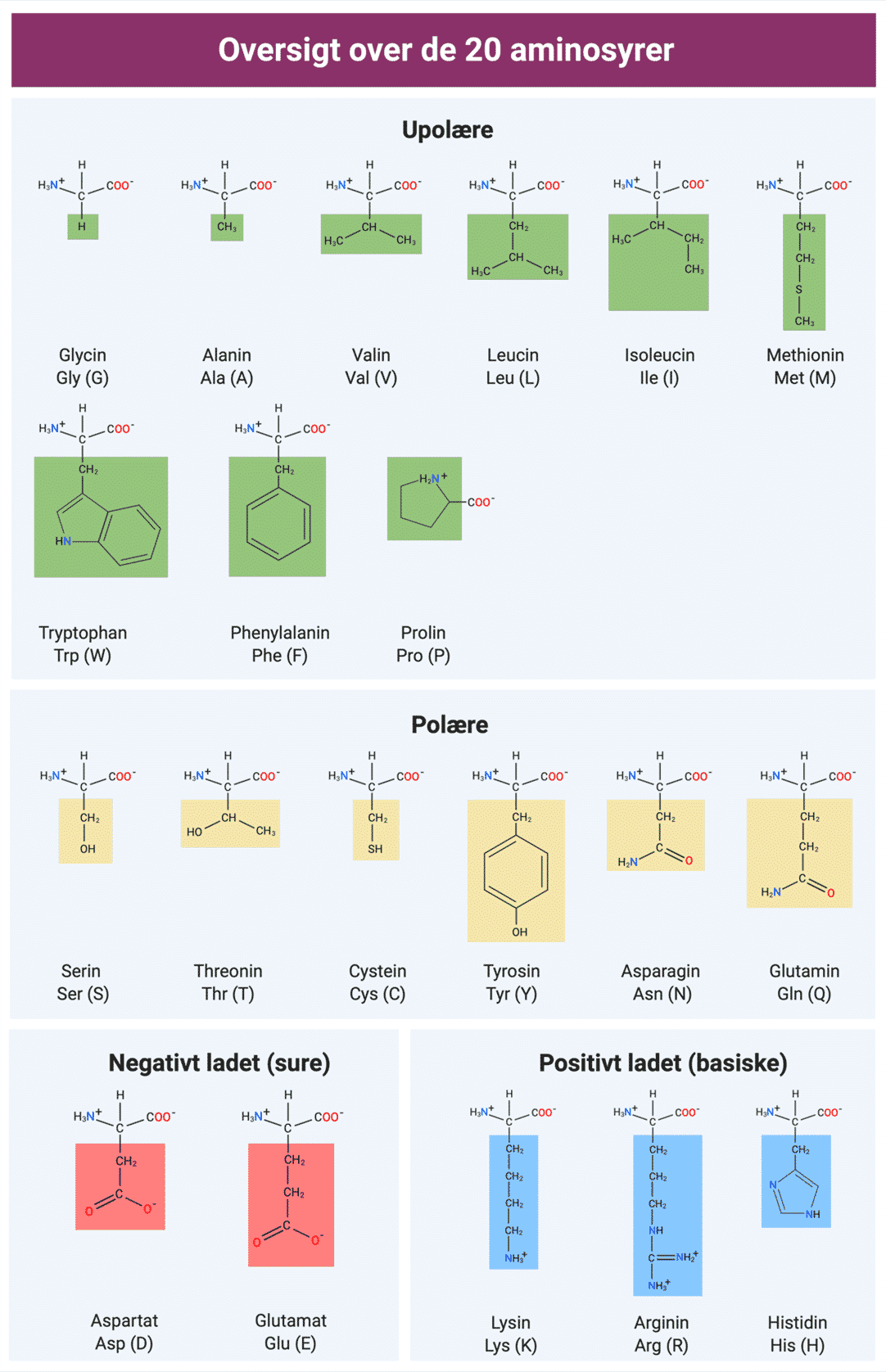
Proteiner er polymerer af aminosyrer. Når man omtaler aminosyrer i proteiner, refererer man til de 20 almindelige aminosyrer (figur 12), der kodes for i DNA. Der findes faktisk over 140 aminosyrer, da disse 20 aminosyrer kan blive modificeret efter translationen. Men her vil der kun være fokus på de 20.
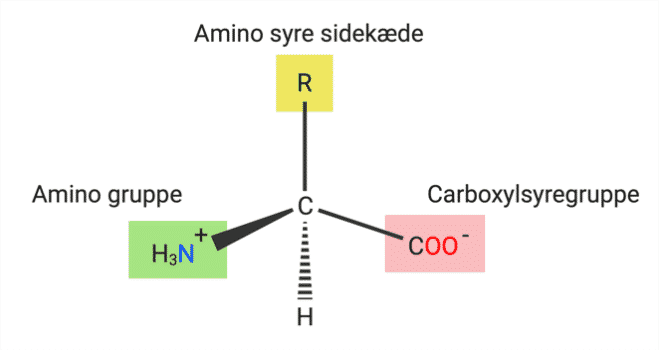
Som det ses i figur 11, har alle aminosyrer et centralt carbon atom, der er bundet til et hydrogenatom, en ladet primær amin (NH3+), også kaldet en aminogruppe, samt en ladet carboxylsyregruppe (COO-), og en variabel siddekæde R.