Intermolekylære bindinger
For at forstå, hvordan enzymer og substrater interagerer på molekylært niveau, er det også vigtigt at forstå, hvilke typer af bindinger der kan dannes mellem molekyler. Disse bindinger kaldes intermolekylære bindinger.
Intermolekylære bindinger afgør de fysiske egenskaber af et molekyle, når det interagerer med andre molekyler. Bindingerne har betydning for bl.a. stoffers koge- og smeltepunkt samt polaritet. I et glas vand er det de intermolekylære bindinger mellem H2O molekyler der gør, at vandet ikke fordamper ved stuetemperatur. Der er 4 typer af intermolekylære bindinger; ionbindinger, dipol-dipol interaktioner, hydrogenbindinger, og London-bindinger.
Se nedestående video om intermolekylære bindinger. DISCLAIMER: I videoen bliver der sagt, at H-bindinger er svagere end dipol-dipol-bindinger, hvilket er forkert!
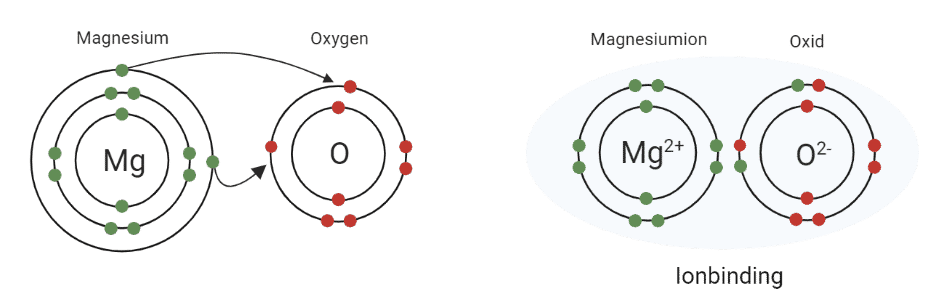
Ionbindinger er de stærkeste af de intermolekylære bindinger og dannes mellem ladede atomer eller molekyler – bedre kendt som ioner. Ionerne skabes ved, at et atom eller molekyle enten afgiver eller optager en elektron fra et andet atom eller molekyle. Dette danner to ioner med modsat ladning, som nu tiltrækkes af hinanden og danner en binding.
Positivt ladede ioner som Na+ (natriumion) og NH4+ (ammoniumion) kaldes kationer, og negativt ladede ioner som Cl– (chlorid) og COO– (carboxylat) kaldes anioner.
Figur 1: Ionbinding mellem magnesium og oxygen, der danner magnesiumoxid til sammen.
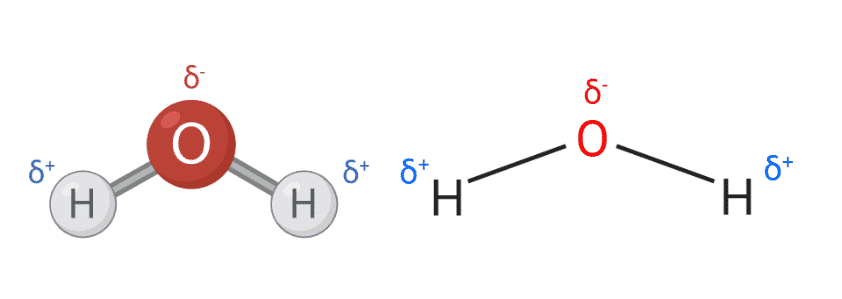
Dipol-dipol interaktioner opstår i molekyler med permanente dipoler. I en polær binding, vil det atom, der er mere elektronegativt, trække elektronerne i bindingen til sig. Elektronegativiteten er et udtryk for et atoms evne til at trække i elektronerne i en kemisk binding; jo højere elektronegativiteten er, jo bedre evne har atomet til at trække elektroner til sig. Der opstår derved en negativ dipol, betegnet δ+, og positiv dipol, betegnet δ–. Dipol-dipol interaktion i et molekyle gør et molekyle polært.
Figur 2: Vandmolekyle vist med polaritet.
Hvis man har en blanding af molekyler med permanente dipoler, vil de negative og positive poler i molekylerne tiltrække hinanden. Dipol-dipol interaktion gør, at molekylerne hænger bedre sammen, og derved har de også et højere koge- og smeltepunkt, da det kræver mere energi at bryde dipol-dipol interaktion. Det er netop pga. dipol-dipol interaktioner, at vand er flydende ved stuetemperatur.
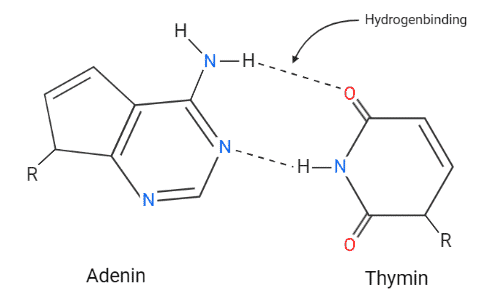
Hydrogenbindinger en type af dipol-dipol interaktioner. Disse bindinger opstår mellem et hydrogenatom i ét molekyle og et meget elektronegativt atom i et andet molekyle, som enten er oxygen (O), nitrogen (N) eller fluor (F). Hydrogen er svagt elektropositivt. Derfor tiltrækkes det af frie elektronpar i et elektronegativt atom. Hydrogenbindinger har en betydelig rolle for vands fysiske egenskaber, og det er også hydrogenbindinger, der dannes mellem basepar i DNA. Disse typer bindinger tegnes med stiplede linjer, når de skal illustreres.
Figur 3: Adenin og thymin fra DNA vist med de to hydrogenbindinger de danner.
Da elektroner altid er i bevægelse, vil de til tider være ujævnt fordelt i et molekyle. Den ujævne fordeling skaber et kortvarigt dipolmoment. Herefter flytter elektronerne sig igen, og dipolen opstår et andet sted i molekylet. Bindinger mellem kortvarige dipolmomenter i to molekyler kaldes London–bindinger. Det er den svageste binding, og den finder sted i alle molekyler, da alle molekyler indeholder elektroner. London-bindinger er væsentlige for at upolære molekyler hænger sammen, da der skal være en positiv og negativ pol, der kan tiltrække hinanden, for at molekylerne hænger sammen.
I biokemi taler man ofte om hydrofobe effekter, der også bliver kaldt hydrofobe interaktioner. Disse effekter er vigtige, da de spiller en væsentlig rolle for bl.a. foldningen af proteiner. Hydrofobe effekter er ikke bindinger, men et fænomen man bruger til at beskrive, hvordan upolære molekyler eller sidegrupper har en tendens til at aggregere, altså klynge sig sammen. Det skyldes hydrofobe effekter, at kugleformede proteiner har hydrofobe indre og hydrofile ydre, hvilket gør dem vandopløselige. I en vandopløsning vil upolære molekyler samle sig sammen og ekskludere vandet. Dette forklarer også, hvorfor man har 2 faser, hvis man blander vand og olie – da polære og upolære væsker vil ikke blande sig.