Nedbrydning af plastik
Resume: I 2018 blev der produceret over 350 millioner tons plastik i hele verden. Det meste af den brugte plastik kommer fra emballage, som udgør hele 40% af al plastik i Europa.
Brug af plastik til fødevarer er smart, da det reducerer massen af indpakning. Men plastikken forurener vores klode fordi det er meget svært at nedbryde. I dette undervisningsmateriale fokuserer vi på plastik, enzymer, og hvordan nogle mikroorganismer kan nedbryde plastik.
Plastik er meget modstandsdygtigt overfor nedbrydning. Dét er en af plastiks mange fordele. Dog har det også vist sig at forsage store miljømæssige problemer. For selvom vi flittigt affaldssorterer vores plastik, så det kan blive genanvendt, er det ikke helt så enkelt. Det plastik, der ender til genbrug, er typisk en blanding af forskellige farver. Al den plastik bliver omsmeltet ved meget høje temperaturer, og resultatet er en grå eller sort plastik, som få firmaer vil have lyst til at bruge som emballage. Dette bliver f.eks. til gulvtæpper, eller andet plastik, man anser for at have ”lav værdi”. Til sidst kan plastikket ikke smeltes om til ny plastik længere og ender på lossepladser eller bliver brændt på et forbrændingsanlæg. Der er så derfor ikke længere tale om egentlig genanvendelse.
Man står derfor overfor et problem, da man gerne vil af med den enorme mængde af plastik, der har ophobet sig på vores klode. Spørgsmålet er derfor så, om man kan gøre afskaffelsen og genanvendelsen af plastik mere bæredygtig?
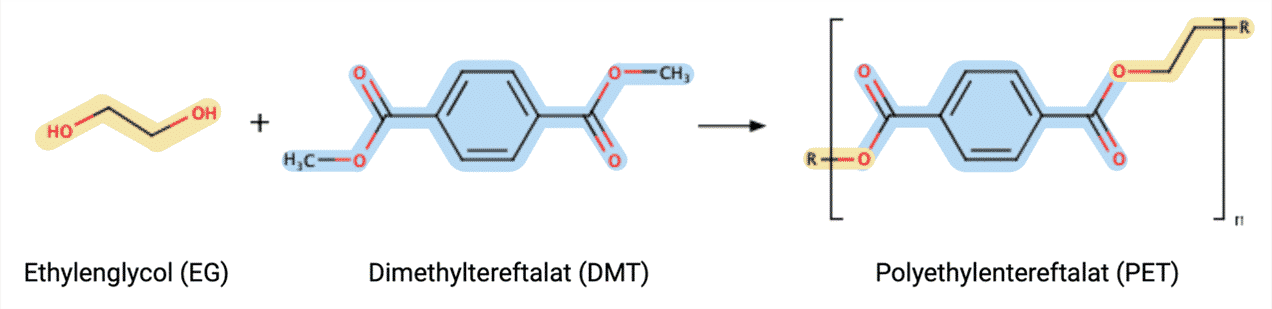
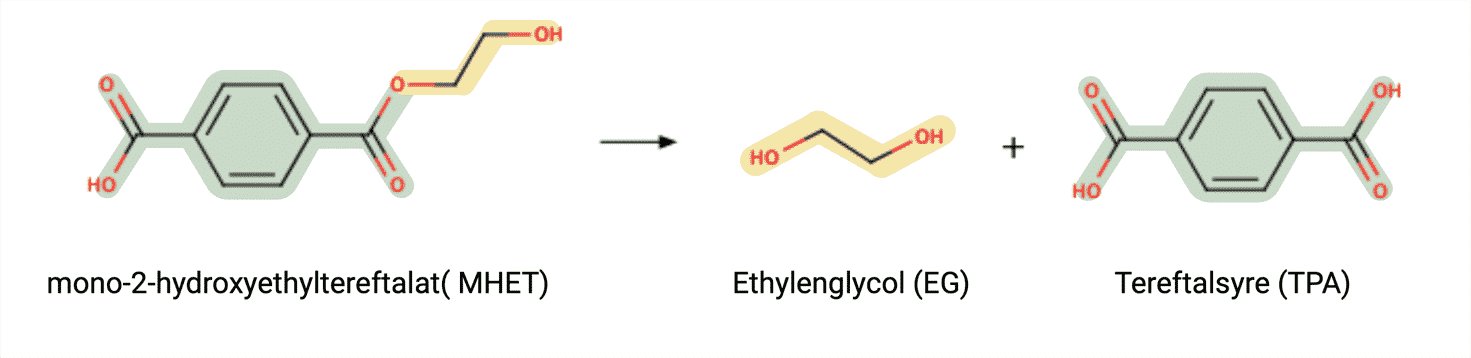
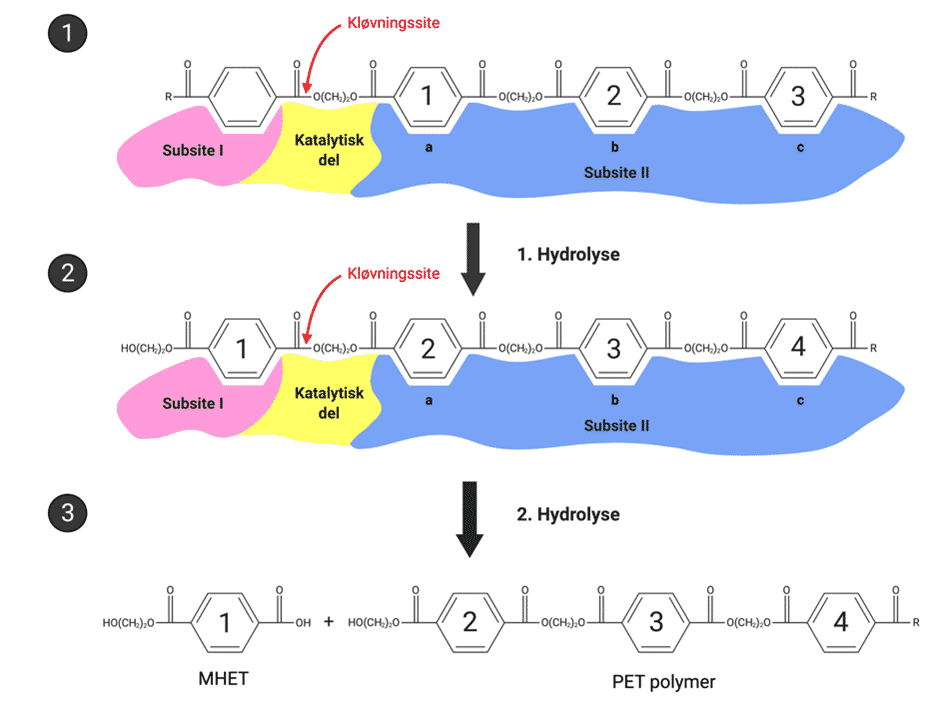
Kernen af bioteknologi er at anvende naturen til menneskers fordel. Når det kommer til at nedbryde et så holdbart materiale som plastik, er dette ikke en undtagelse. Forskere har for nyligt fundet en bakterie, der har udviklet sig til at kunne nedbryde og metabolisere et plastik ved navn PET. Det er da fantastisk! Da plastikaffald først har været tilstede i naturen siden 1960’erne, viser det, hvor hurtigt mikroorganismer er til at tilpasse sig. Dette projekt vil kigge nærmere på bionedbrydningen af PET vha. enzymer og forklare kemien bag dette.
God fornøjelse med projektet!