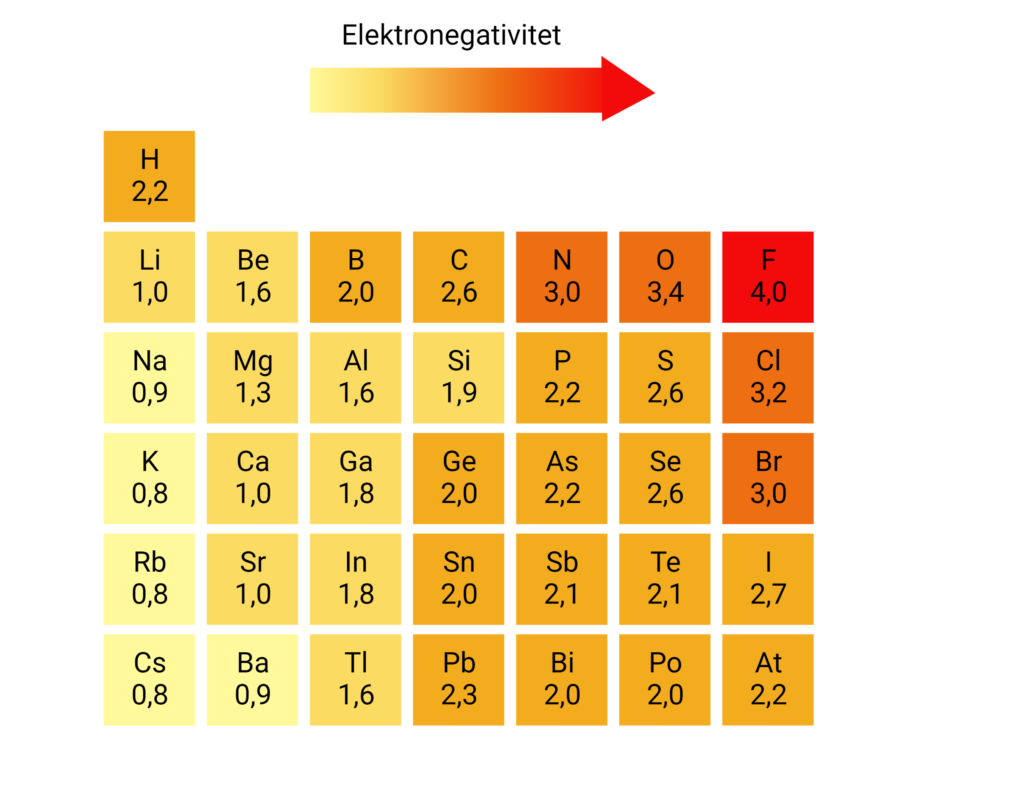
Polaritet er en delvis forskydning i ladningen af et molekyle. I molekyler er atomerne bundet sammen ved at dele elektroner med hinanden, men elektronerne er ikke altid fordelt lige imellem atomerne. Nogle atomer trækker mere i elektronerne end andre, og det er sådan, polaritet opstår. I et polært molekyle er en del af molekylet positivt ladet, mens en anden del af molekylet er negativt ladet. Du kan se et eksempel på et polært molekyle på figur 1. Et atoms evne til at trække i elektronerne kaldes elektronegativitet. På figur 2 kan du se en række forskellige atomers elektronegativitet.
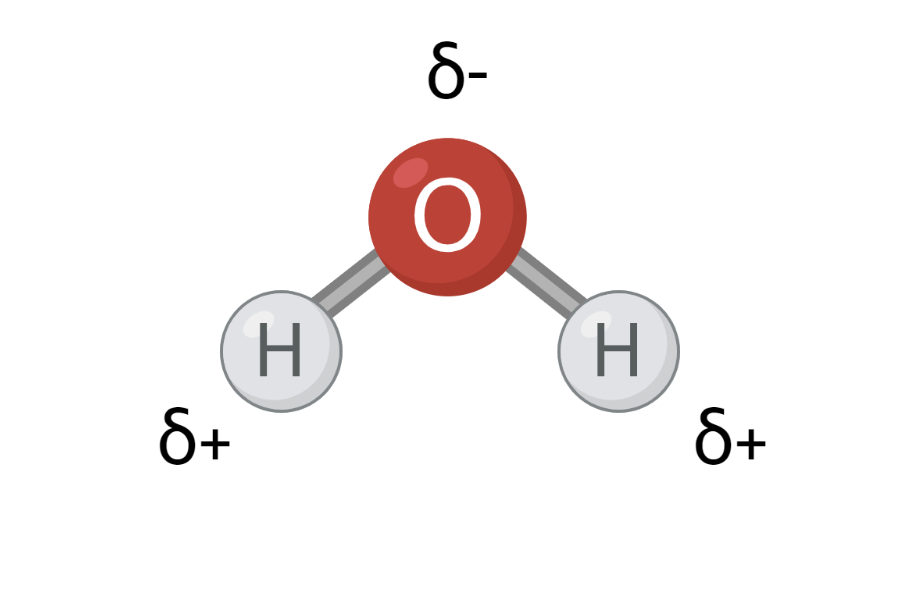
Atomer har i sig selv ikke nogen overordnet ladning, fordi de har lige mange elektroner og protoner. Når de indgår i bindinger med hinanden, kan de dog få en lille ladning. Det skyldes, at elektronerne i bindingen kan befinde sig tættere på det ene atom end det andet. Derved kommer der relativt færre eller relativt flere elektroner ift. protoner omkring hvert enkelt atom.
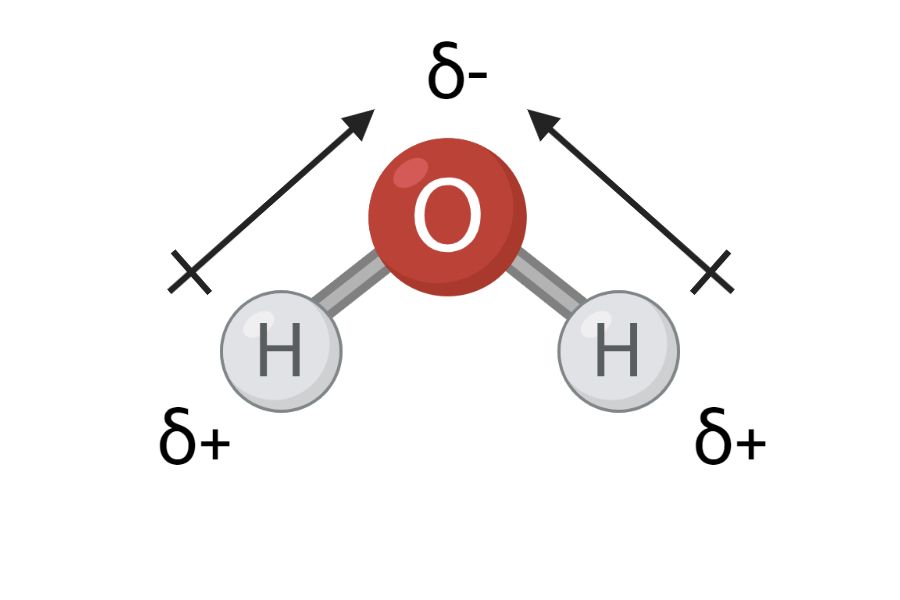
På figur 2 kan du se, at oxygen har en elektronegativitet på 3,4, og hydrogen har en elektronegativitet på 2,2. Det betyder, at oxygen trækker mere i elektronerne end hydrogen i en O-H binding. Elektronerne i O-H bindingen vil derfor være tættere på oxygen end hydrogen – også kaldet en ladningsforskydning. Elektroner er negativt ladet, og når de ligger tættere på oxygen, får oxygenatomet en delvis negativ ladning. Samtidig ligger elektronerne lidt længere væk fra hydrogen, og hydrogenatomet får derfor en delvis positiv ladning. Den delvise ladning angives med et lille delta, δ, over hvert atom samt enten et minus (-) eller plus (+), som kan ses på figur 3.
Elektronegativitetsforskel
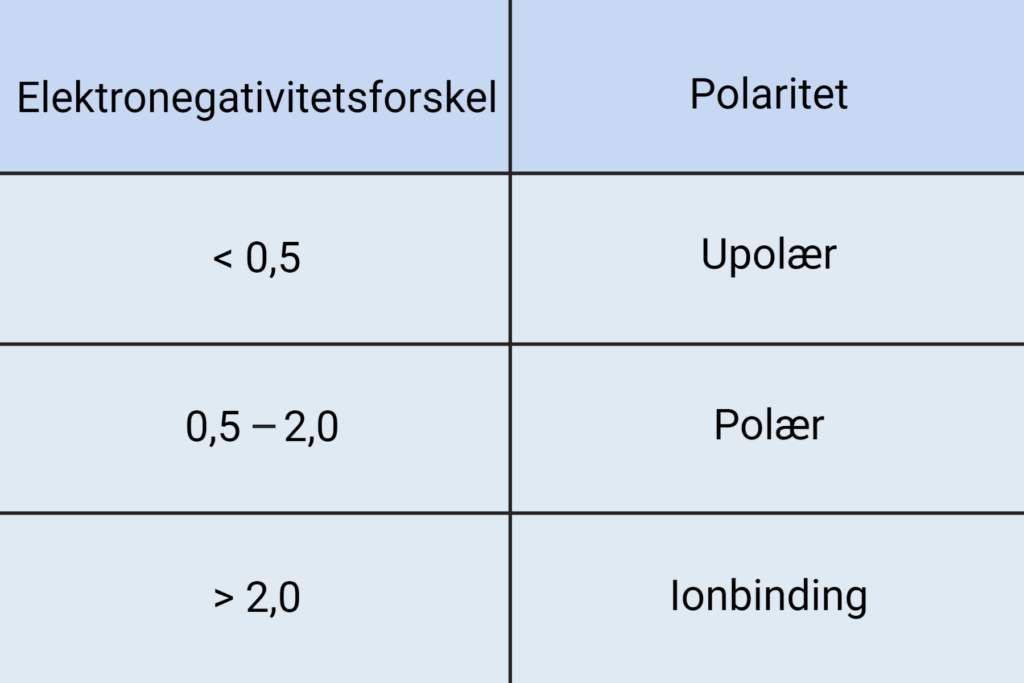
For at finde ud af om et molekyle er polært, kan man beregne elektronegativitetsforskellen af alle bindingerne i molekylet. Hvis man tager vand, H2O, som eksempel, skal man beregne elektronegativitetsforskellen i O-H bindingerne. Ved at aflæse værdierne på figur 2 kan man beregne elektronegativitetsforskellen til 3,4-2,2=1,2 i hver O-H binding. Jo større elektronegativitetsforskellen er, desto større er ladningsforskydningen, og jo mere polær er bindingen. I tabel 1 kan du se sammenhængen mellem elektronegativitetsforskel og polaritet. En O-H binding er altså polær.
Det er dog ikke nok kun at kigge på elektronegativitetsforskellen af alle bindingerne i et molekyle, når man vil afgøre, om det er polært.
Geometri påvirker molekylets polaritet
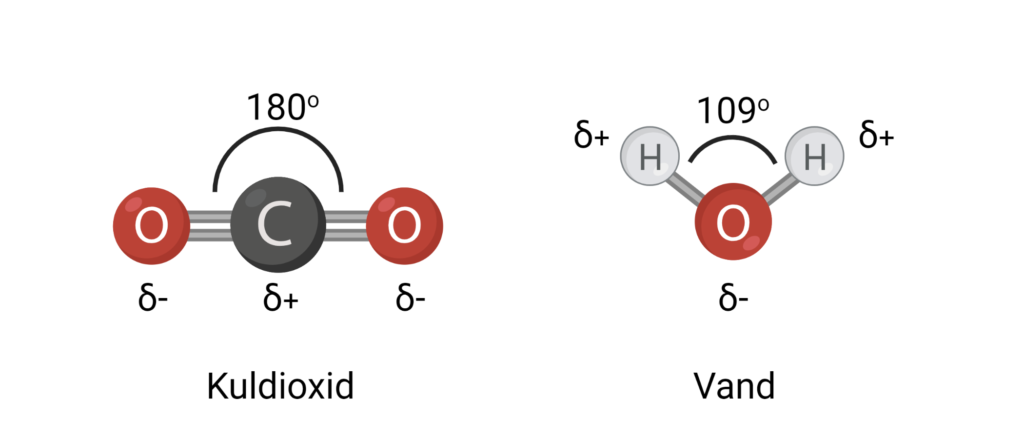
Man kan kun vurdere, om et molekyle er polært ved også at kigge på dets geometri. Molekylets rumlige opbygning afgør nemlig dets overordnede ladning. På figur 4 kan du se to eksempler på molekyler med polære bindinger: Kuldioxid og vand. Tidligere lærte du, at O-H bindingerne i vand er polære. C=O bindingerne i kuldioxid er også polære, fordi de har en elektronegativitetsforskel på 3,4-2,6=0,8. På trods af de polære bindinger er kuldioxid ikke et polært molekyle. Atomerne i kuldioxid ligger på en helt lige linje, hvilket betyder, at der er 180o imellem C=O bindingerne. Oxygenatomerne trækker derfor lige meget i elektronerne i hver sin retning. Det får de to ladningsforskydninger fra hver C=O binding til at ophæve hinanden. Det betyder, at den overordnede ladning af molekylet er 0, og kuldioxid er upolært. I vand er vinklen mellem O-H bindingerne 109o. Vand er derfor et polært molekyle.
1:4 Reglen
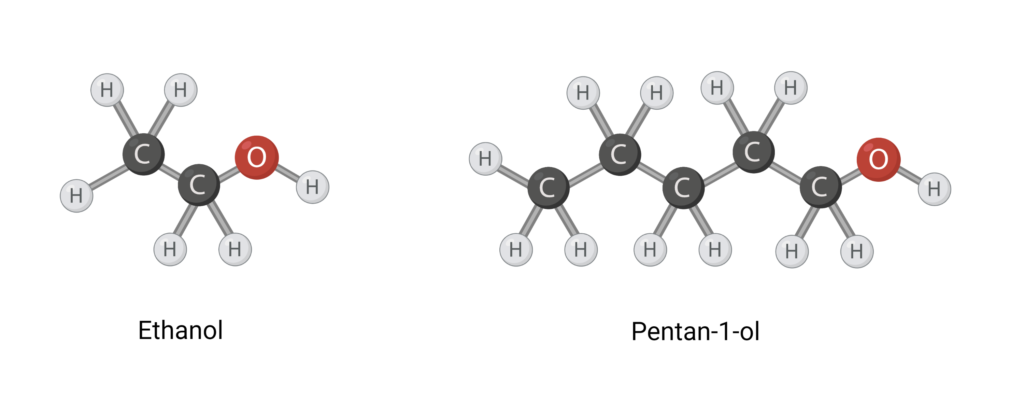
Det er sjældent, at der kun er én slags bindinger i et molekyle, som det er tilfældet for kuldioxid og vand. Når man kigger på polariteten af et større molekyle, kan man derfor kigge på antallet af polære bindinger i forhold til antallet af upolære bindinger. Hvis man arbejder med organiske forbindelser med kulstofatomer, er en tommelfingerregel, at der skal fire kulstofatomer med upolære grupper til at opveje én polær gruppe. Organiske forbindelser indeholder ofte mange C-H bindinger. De er upolære, da elektronegativitetsforskellen er 2,6-2,2=0,4. Ethanol og pentan-1-ol på figur 5 er to eksempler på organiske forbindelser. Ethanol indeholder én polær O-H binding og to kulstofatomer med upolære C-H bindinger. Hvis man bruger 1:4 tommelfingerreglen, kan ethanol derfor betragtes som et polært molekyle. Pentan-1-ol er derimod et upolært molekyle. Det indeholder fem kulstofatomer med C-H bindinger, der opvejer den polære O-H binding.
Hydrofobe og hydrofile molekyler
Hydrofob og hydrofil er en anden måde at beskrive polaritet på. Når man taler om hydrofilicitet, taler man om molekylers evne til at blande sig med vand. Molekyler vil helst blande sig med andre molekyler, som minder om dem selv. Vand er som nævnt et polært molekyle. Andre polære molekyler blandes godt med vand, og de kaldes derfor for hydrofile. Upolære molekyler blandes ikke særlig godt med vand, og de kaldes derfor for hydrofobe. Hydrofob betyder også vandskyende, og hydrofil betyder vandelskende. Som huskeregel kan man tænke på, at en fobi er, når man er bange for noget. Hydrofobe molekyler er ”bange for” vand, og de vil derfor helst ikke blande sig med vand.
Et hverdagseksempel
Olie er et upolært molekyle, som indeholder lange kæder af kulstofatomer med C-H bindinger. Det blander sig ikke særlig godt med vand, som er polært. Hvis man prøver at blande olie og vand, vil olien samle sig til dråber oven på vandet. Det gør den for at mindske kontakten med vandet. Man kan derfor også kalde olie for hydrofobt.
« Back to Glossary Index
