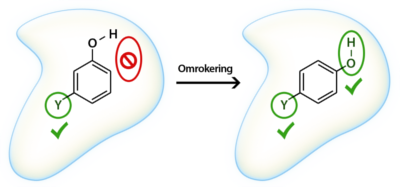
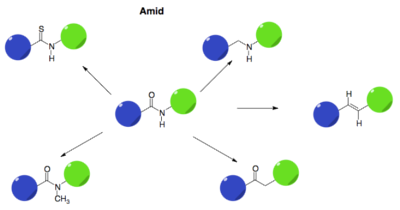
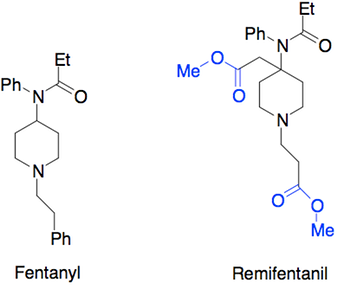
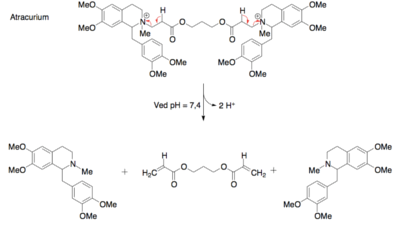
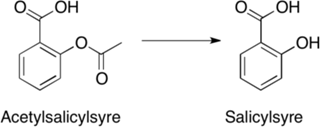
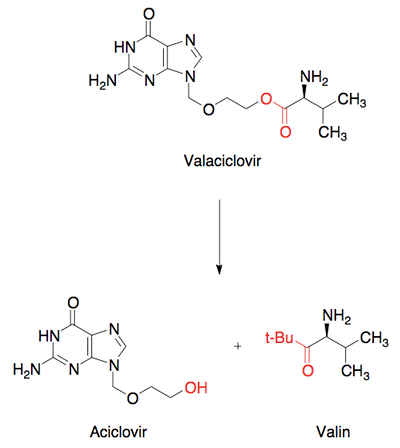
Det modsatte scenarium, hvor molekylet er for upolært, kan også ændres, så det bliver mere polært. Den nemme løsning på dette problem er at tilføre ekstra polære grupper til molekylet. Dette er selvfølgelig ikke altid muligt, eksempelvis fordi der på den måde måske vil blive tilføjet funktionelle grupper, der kan lave uønskede bindinger i target, eller fordi der bare ikke er plads til ekstra funktionelle grupper i molekylet. Hvis det ikke er muligt at indføre flere funktionelle grupper, kan det være muligt at ændre på de grupper, der allerede er til stede i molekylet. Det kan fx være en methylether, som kan ændres til en alkohol, eller der kan måske fjernes grupper, som gør dele af molekylet hydrofobt.
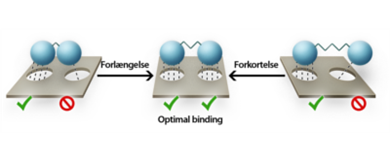
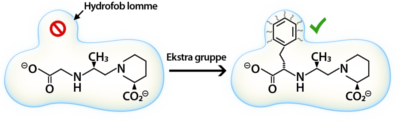
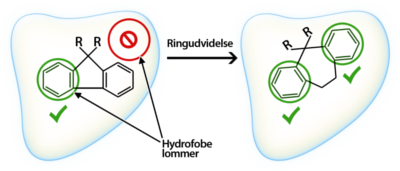
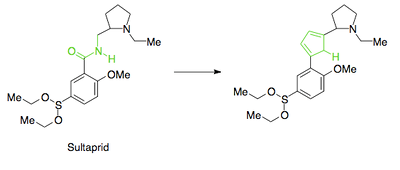
Det er vigtigt, at der er hydrofobe grupper rundt omkring i hele molekylet, da det ellers kun vil være den ene side af molekylet, der vil være hydrofob nok til at blive optaget over cellemembraner. Hvis de hydrofobe grupper ikke er fordelt ligeligt i molekylet, kan man risikere, at den ene del af molekylet sidder i membranen, mens den anden del af molekylet stikker ud af membranen. På den måde bliver molekylet fanget i membranen. Det kan være en god ide at variere størrelsen på de hydrofobe grupper, så de forlænges på den ene side og forkortes på den anden side af molekylet, således at de hydrofobe grupper er fordelt jævnt hele vejen rundt om molekylet.
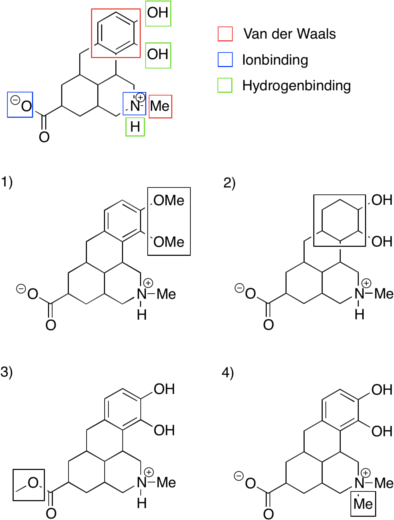
Når et lægemiddels pKs kommer uden for det optimale område, pKS = 6-9, er der stor sandsynlighed for, at det vil være for ioniseret, og derfor ikke vil kunne optages over cellemembraner. Hvis pKs er uden for det optimale område, skal man enten gemme funktionelle grupper, som er meget basiske eller meget sure, eller fjerne disse grupper. Man kan for eksempel gemme et basisk nitrogenatom inde i en heteroaromatisk ring.
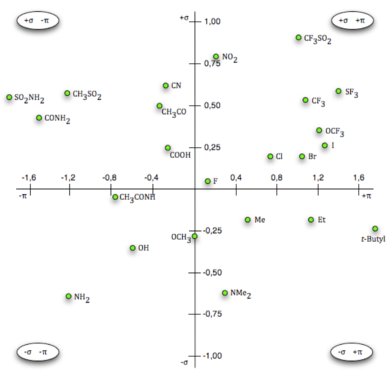
Craig plot
I nogle tilfælde kan det være svært at vide, hvilke funktionelle grupper der skal ændres, eller hvad grupperne skal ændres til, for at øge aktiviteten af et lægemiddel. Et lægemiddel har nogle fysisk-kemiske egenskaber, som kan relateres til den biologiske aktivitet. Der er to fysisk-kemiske egenskaber, der er specielt vigtige i forhold til biologisk aktivitet. Den ene egenskab er hydrofobiciteten af molekylets funktionelle grupper, og den angives med det græske tegn pi, π. π > 0 angiver, at molekylet er hydrofobt, mens π < 0 angiver, at molekylet er hydrofilt. Den anden egenskab er, hvor elektrondonerende eller -tiltrækkende en aromatisk substitut er i lægemidlet. Denne egenskab angives med det græske tegn sigma, σ. Hvis σ > 0 betyder det, at den aromatiske substitut er elektrontiltrækkende, mens den aromatiske substitut er elektrondonerende, hvis σ < 0. Når π og σ indtegnes i et diagram for forskellige funktionelle grupper fremkommer det, der i farmakologien kaldes et craig plot. Ud fra et craig plot kan man danne sig et overblik over, hvilke funktionelle grupper man kan ændre de nuværende substituenter i et molekyle til, for fx at ændre hydrofobiciteten af molekylet. Figur 55 er et craig plot for aromatiske substituenter i para-stillingen. Para-stillingen for aromatiske ringe er beskrevet nærmere i artiklen ”Organisk kemi og lægemidler”. Et lægemiddel der har en t-butyl gruppe (ligger i 4. kvadrant i craig plottet), vil være meget hydrofobt grundet denne gruppe. Det kan være at molekylet er så hydrofobt at logP-værdien ligger over 5. Det er derfor nødvendigt at ændre på lægemidlets funktionelle grupper, så det bliver mindre hydrofobt. Man kan derfor bruge craig plottet til at se, hvilke grupper der er mindre hydrofobe en t-butyl. Gruppen Me (Methyl), har en lavere π-værdi end t-butyl og en udskiftning vil derfor gøre molekylet mindre hydrofobt, hvorved logP-værdien vil sænkes til under 5. Det kan nu være muligt at indtage lægemidlet oralt.