Organisk kemi og lægemidler
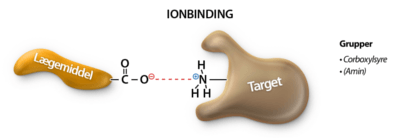
Hvis man kender sit target og de aminosyrer der er involveret i binding til et lægemiddel er det muligt at designe et lægemiddel ud fra kemisk viden. Lægemidlets funktionelle grupper skal tilpasses således, at de rette interaktioner skal kunne finde sted mellem target og lægemiddel.
Farmakofor og scaffold
Farmakoforen er et udtryk for de funktionelle grupper der er i et lægemiddet, og dermed hvilke bindinger, der er essentielle for aktiviteten af et lægemiddel. Et scaffold er derimod en grundstruktur, som giver et godt udgangspunkt for udvikling af lægemidlet.
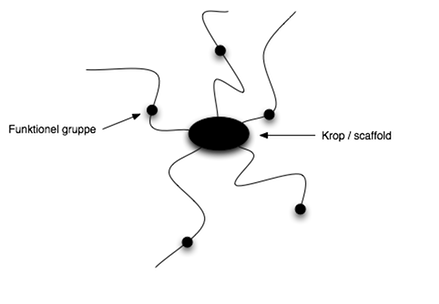
Når man skal udvikle et nyt lægemiddel, skal man først og fremmest at have en god grundstruktur, altså et godt scaffold. Til et scaffold kan man binde forskellige funktionelle grupper (R-grupper), som skal lave interaktioner til target, så den bedst mulige binding opnås. Et godt scaffold er et lille molekyle, hvor der fordelt rundt på hele molekylet er mulighed for at påsætte funktionelle grupper. Scaffoldet og dets funktionelle grupper kan sammenlignes med en edderkop, fordi en edderkop har en krop med ben fordelt ligeligt rundt på hele kroppen, ligesom et scaffold helst skal have.
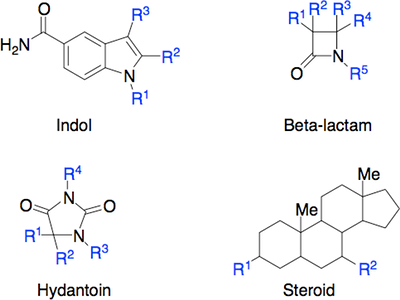
Tror du at indol som ses i figur 14, er et godt scaffold? Hvad med β-lactam, hydantoin og en steroid?
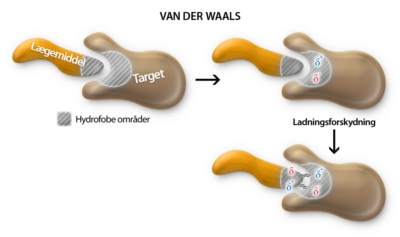
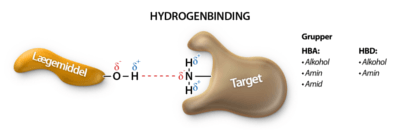
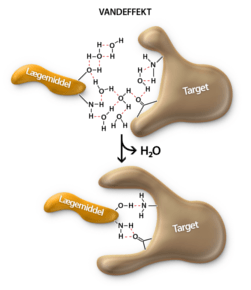
Når et scaffold er valgt, vælges sidegrupperne primært baseret på hvilke bindingsinteraktioner de kan lave. De bindinger der er i selve lægemidlet er forskellig fra de bindinger der er mellem et lægemiddel og et target. De bindinger der finder sted i selve lægemidlet, kaldes for intramolekylære bindinger, eller i daglig tale for kovalente bindinger. De bindinger der er mellem lægemiddel og target kaldes for de intermolekylære bindingstyper, da disse bindingstyper eksisterer imellem molekyler. De intermolekylære bindinger findes der flere forskellige af og vil blive gennemgået i denne tekst.
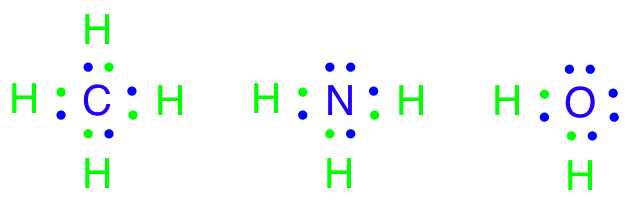
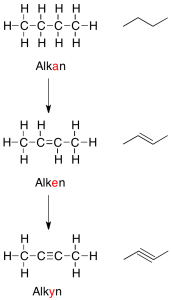
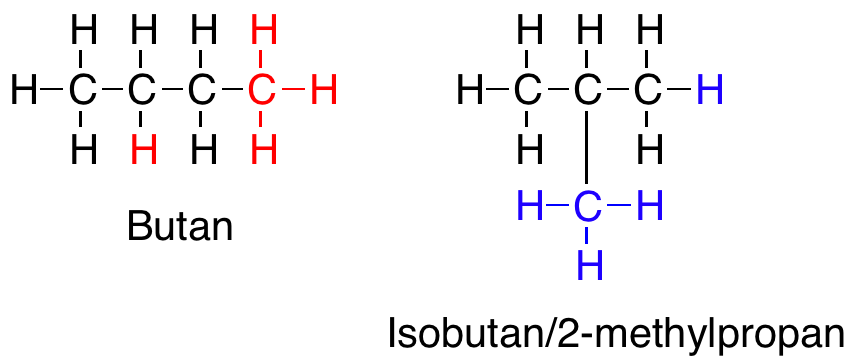
Men hvorfor binder atomer sig overhovedet sammen? Svaret er, at de binder sig til hinanden, fordi de gerne vil ligne en af ædelgasserne. En ædelgas, er et atom, der ligger i 8. hovedgruppe i Det Periodiske System. Atomer vil meget gerne have karakter af en ædelgas, fordi en ædelgas er meget stabil, idet den opfylder oktetreglen om at have 8 valenselektroner. Det er også derfor, at carbon laver lige netop fire bindinger til andre atomer. Carbon har fire valenselektroner og ved at optage fire elektroner mere fra andre atomer, der er villige til at donere eller dele en elektron, vil oktetreglen være opfyldt. Dette kan både opfyldes af fire atomer eller af færre atomer, fordi nogle atomer donerer mere end én elektron, således at der dannes en dobbelt- eller trippelbinding mellem donor- og carbonatomet.