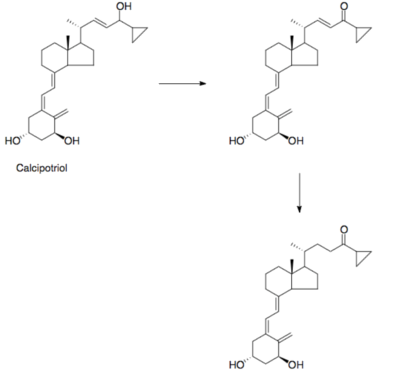
Introduktion til lægemidler
Vi har sikkert alle på et tidspunkt i vores liv benyttet en eller anden form for lægemiddel. Det kan være en hovedpinepille fra tid til anden, antibiotika til at slå en infektion ned med, en antihistamin mod allergi, eller astmamedicin. Du kan sikkert komme i tanke om en del andre former for medicin, som du har brugt på et tidspunkt i dit liv, og det burde være tydeligt, at lægemidler har mange forskellige funktioner. En generel definition af, hvad et lægemiddel er: ”Et lægemiddel er et produkt, som er bestemt til at blive tilført mennesker eller dyr for at forebygge, lindre, behandle eller helbrede sygdom, sygdomssymptomer og smerter, eller for at påvirke legemsfunktioner”. Selvom denne definition er let forståelig, er udviklingen af lægemidler langt fra enkel. Den brede definition af et lægemiddel tillader desuden en stor gruppe af meget forskellige kemiske stoffer at blive anvendt.
Det kræver interdisciplinær forståelse og kreativitet at udvikle nye lægemidler, og der vil undervejs i processen uden tvivl opstå problemer. Disse problemer kan være af forskellig art. Det kan dels være komplikationer ved optagelse af lægemiddel i kroppen, dels kan der være toksiske, altså giftige, bivirkninger, og dels kan det forekomme at det aktive stof i lægemidlet ikke binder tilstrækkeligt til sit target. Grundet disse mulige problematikker, vil dette materiale give dig indsigt i, hvilke ting du skal tage højde for, når du skal designe dit eget lægemiddel.