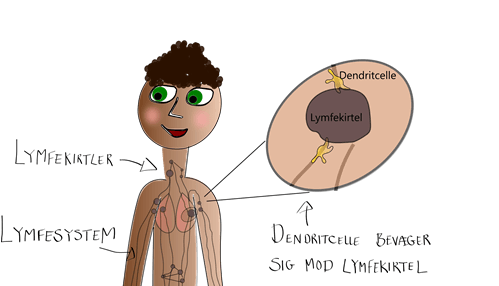
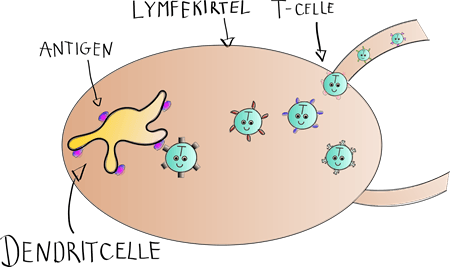
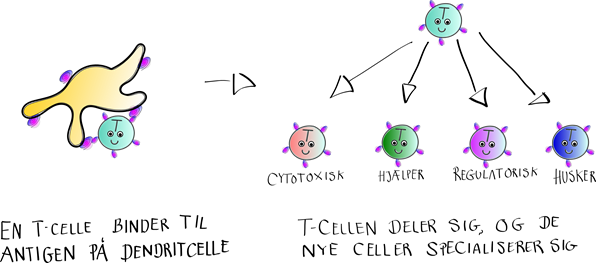
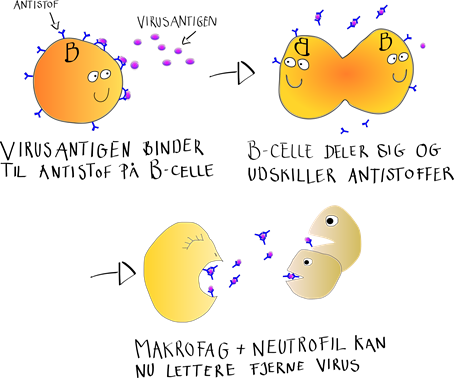
Ligesom T-cellerne udvikler B-cellerne sig til bestemte typer af celler, når de deler sig efter at være blevet aktiverede.
- Plasma B-celle: Denne celle er af den type, der producerer rigtig mange antistoffer.
- Regulatorisk B-celle: Ligesom for den regulatoriske T-celle, hjælper denne celle med at holde immuncellerne i skak, så de ikke går over gevind.
- Huske B-celle: Ligesom huske T-cellen bliver denne type celle i kroppen i meget lang tid efter at sygdommen er udryddet, og fungerer dermed som et vagtværn mod at du kan blive syg med den samme virus igen og igen.
Finalen – et velkoordineret angreb
Nu har du ligget i sengen i et par dage, og de specialiserede B- og T-celler er blevet fundet, og er begyndt at dele sig, så de kan gå i krig mod den indkomne virus. Som nævnt laver B-cellerne antistoffer, der binder til virussen, sådan at den lettere kan spises af makrofagerne og neutrofilerne. Samtidigt er der blevet lavet cytotoksiske T-celler der, ligesom NK-cellerne kan få virus-inficerede celler til at begå selvmord. T-cellerne har dog den fordel i forhold til NK-cellerne, at de er meget bedre til at genkende den celle, der råber om hjælp.
Dette samspil imellem de innate immunceller, der holder sygdommen nede i starten og samtidigt sørger for at aktivere de adaptive immunceller, er det der gør, at du gang på gang bekæmper din influenza og ender med at være rask igen efter relativt få dage. Det der sker i slutningen af sygdommen, når virus er ved at være udryddet er, at de regulatoriske B- og T-celler tager over. De udsender bestemte stoffer, som dæmper de andre immuncellers aktivitet. Denne sidste fremrykning er nødvendig for, at du hurtigt kan føle dig rask igen. Husk på at makrofagerne og mastcellerne udsender stoffer som fx histamin, som danner en inflammatorisk tilstand i fx lungerne. Når de først er aktiverede, aktiverer de så at sige sig selv og skal have besked på at slappe lidt af. Fx skal de standse produktionen af histamin og selv begynde at overveje at begå selvmord. Nu har du jo ikke brug for alle de celler mere.
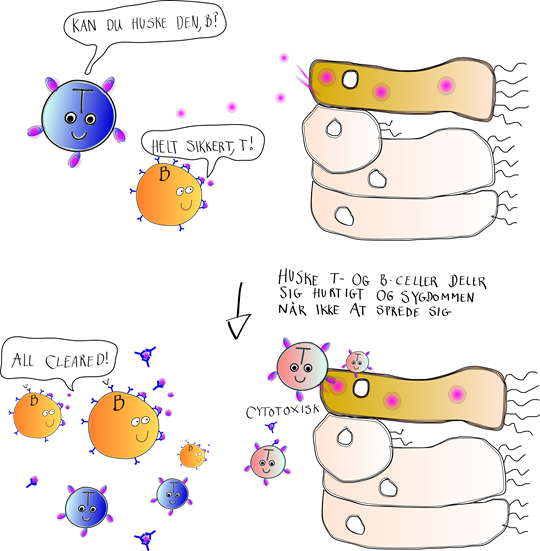
Altid på vagt overfor dødsfjenden
Igennem et sygdomsforløb med en influenza virus har dit immunsystem arbejdet hårdt på, at du skal få det bedre. Du kan mærke, at du begynder at få det bedre og føler dig snart klar til at stå ud af sengen, og til at bage kage, spille håndbold, guitar, Minecraft, eller hvad du nu får tiden til at gå med. Når du så er blevet helt rask, og igen springer glad ud af sengen hver morgen, fordi du glæder dig til at skulle i skole, foregår der faktisk stadig noget inde i din krop.
For selvom du måske hurtigt glemmer, at du var syg, så husker din krops immunsystem det i meget lang tid. Tilbage i kroppen er der nemlig Huske T-cellerne og Huske B-cellerne som stadig cirkulerer rundt, altid på vagt overfor, at deres helt personlige fjende (virussen) skulle komme igen. Hvis det skulle ske, at du igen bliver inficeret med den samme virus, aktiveres Huske-cellerne lynhurtigt og igangsætter et hurtigt og effektivt angreb imod den. Meget hurtigere end første gang du blev udsat for virussen. Dette skyldes, at der ikke er brug for det innate immunsystem til at aktivere Huske-cellerne. De aktiveres direkte af at binde til viruspartiklens antigen, og begynder at virke med det samme.
Det betyder altså, at selvom du igen udsættes for den samme virus så bliver du ikke syg. Så når din lillesøster nu er blevet syg efter at have lavet te til dig, og tømme din snotpapirs-skraldespand, så bliver du ikke smittet når du tømmer hendes snotpapirs-skraldespand (som du selvfølgelig gør hvis du er en god søster..). Uden denne hukommelse over for sygdomme, så ville din familie og dig fx kunne blive ved med at smitte hinanden i én uendelighed!
Vacciner – virker ved at drille de adaptive immunceller
Denne viden om at kroppen husker hvilke sygdomme, den allerede har haft, er den man også udnytter, når man laver vacciner. Ved en vaccination kan man nemlig få kroppen til at huske sygdommen, selvom man ikke har oplevet at være syg. Rent praktisk så sprøjter man en virus eller en bakterie ind i kroppen, som er den samme som den man bliver syg af, men som man har svækket, så den ikke er ligeså god til at inficere dine celler. Immunsystemet opdager den derfor, men virussen eller bakterien spreder sig så langsomt, at du ikke når at blive rigtigt syg.
Der er stor forskel på hvor længe en bestemt sygdom huskes af immunsystemet. Det er derfor, der er nogen vacciner, som man skal have flere gange (mod stivkrampe cirka hvert 10. år), hvorimod andre kan give livslang beskyttelse. Det er dog tit sådan, at man skal have en vaccine to eller tre gange inden for en bestemt periode, før immunsystemet kan huske denne sygdom resten af livet. Igen kan man sammenligne Huske B- og T-cellerne med en vagthund: Hvis den samme tyv kommer igen anden eller tredje gang inden for en kort periode, så bliver hunden virkelig god til at jage lige præcist denne tyv væk, og vil huske hvordan tyven så ud i meget lang tid.