Lær ølbrygningsprocessen
Resume: Fremstilling af øl er ikke en proces, der lige er blevet opfundet, men der bliver hele tiden forsket i alle dele af ølbrygningsprocessen, således at fremstillingen kan optimeres. Projektet giver dig et indblik i den forskning og udvikling, der foregår i en dansk bioteknologi virksomhed.
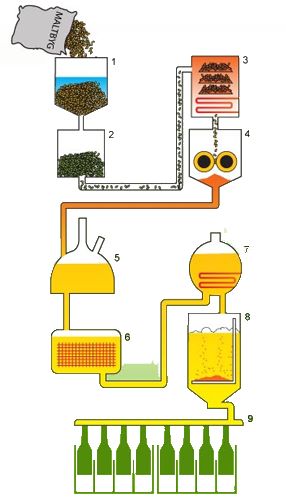
Ølbrygning er verdens første form for bioteknologi. Det er et klart eksempel på, hvordan mennesket teknologisk kan styre biologiske processer og derved producere et biologisk produkt. Fremstilling af øl er altså ikke en proces, der lige er blevet opfundet, men der bliver hele tiden forsket i alle dele af ølbrygningsprocessen, således at fremstillingen kan optimeres. Forbehandling og mæskning er processer der drives af enzymer til stede i den byg, man anvender til ølbrygning. Projektet indeholder en beskrivelse af de relevante enzymer, for at kunne give et bedre indblik i de biologiske processer som ølbrygning kræver. Gæring indebærer vækst af gærceller, hvilket forudsætter en forståelse af de typer sukkerarter, som gær kan vokse på, samt en forståelse for vækstfaserne i en fermenteringsproces.
Projektet giver dig et indblik i den forskning og udvikling, der foregår i en dansk bioteknologi virksomhed. Der er altså mere biologi i ølbrygning, end man måske lige går og tror! Det skulle gerne stå klart efter du har læst teorimaterialet. Først får du en kort beskrivelse af ølbrygningens rige danske historie. I de fem teori afsnit, vil hele ølbrygningsprocessen blive beskrevet i detaljer. Det første afsnit, Introduktion, skal ses som en oversigt, og det er en fordel at have figuren fra denne fremme, mens man læser de tre følgende teoriafsnit. Det sidste afsnit, Vækstfaser, skal ses som supplerende materiale, hvis der eksempelvis udføres vækstforsøg med gær under arbejde med projektet.
Prøv også kræfter med biologien bag ølbrygning, med de tilhørende forsøg!