Immunkemiske metoder
Denne underside udgør sjette del af teorien for Biotech Academys materiale om Immunforsvaret.


Denne underside udgør sjette del af teorien for Biotech Academys materiale om Immunforsvaret.
Immunsystemet er skabt til at finde og bekæmpe infektioner og sygdomme, og det er derfor nærtliggende at anvende immunologien til at udvikle nye behandlingsformer. Disse vil nemlig ligne og kunne bidrage mekanismer, som allerede foregår i kroppen. Men immunologien har også mange andre anvendelsesmuligheder, idet antistoffer kan bruges til diagnosticering og påvisning af stort set alle molekyler. Der er udviklet mange forskellige teknikker til anvendelse i laboratoriet, og i det følgende vil nogle af de vigtigste blive gennemgået.
Agglutinering bygger på princippet om udfældning, og anvendes til daglig inden for mange områder til diagnosticering og som led i andre tests.
På vores blodlegemer sidder antigener, som også findes på resten af kroppens celler. Dette er bl.a. A- og B-antigenerne som er kendt i AB0-blodtypesystemet. En person som har blodtype A, har A-antigener siddende på overfladen af de røde blodlegemer. En person der har blodtype B, har B-antigener på overfladen, mens en person af blodtype 0 ikke har nogen af disse antigener.
A/B-antigenerne findes også på mange bakterier, som vi møder til daglig, og vi bliver derfor stimulerede til at danne antistoffer mod disse antigener. Man bliver så at sige immuniseret mod antigenerne og dermed blod af den type. Således vil en person med blodtype A have B-antistoffer og modsat for en person med blodtype B, mens en person med blodtype 0 vil have såvel A- som B-antistoffer i blodet.
Overførsel af blod af en type, som modtageren er immuniseret overfor, kan være meget farligt. Det medfører, at ens antistoffer angriber de transfunderede blodceller, som dermed ødelægges (hæmolyse). De ødelagte celler hjælper ikke på det, som var meningen med blodstranfusionen, og desuden kan de samtidigt være farlige, da der frigives en masse intracellulære molekyler til blodet. Der skal derfor udøves en stor påpasselighed ved blodtransfusioner, så man sikrer sig, at der er forlig imellem donor- og modtagertypen. Det er derfor nødvendigt at kunne teste, hvilken blodtype man hører til. Blodtypebestemmelse sker ved en agglutineringsreaktion, hvor man påfører blod af ukendt type til en plade, hvorpå der findes antistoffer mod enten A- eller B-antigener. Hvis der er antigener til stede på blodlegemerne i prøven, vil disse udfældes sammen med antistoffet på pladen, og man kan derved bestemme blodtypen. Hvis der ikke er udfældning, er typen 0, og hvis der er udfældning på begge plader, er typen AB.
ELISA er en forkortelse for Enzyme Linked ImmunoSorbent Assay, og er en af de mest anvendte metoder. ELISA er en undersøgelse for tilstedeværelsen enten af antigener eller af antistoffer. Derfor findes der flere forskellige former af ELISA.
En form er det indirekte ELISA, hvor man tester for tilstedeværelsen af antistoffer. Man kan på den måde opdage visse infektioner, hvor mængden af virus eller bakterier er så lav, at man ikke kan teste for dem direkte. Man skal bare have en lille blodprøve for at kunne identificere eventuelle antistoffer mod en inficerende bakterie eller virus i patienten. Rent praktisk foregår det ved, at antigener, specifikke for det antistof man ønsker at teste for, sættes i bunden af en brønd, se figur 16. Herefter tilsættes den prøve, man ønsker at teste for indhold af antistof. Såfremt prøven indeholder de formodede antistoffer, vil disse binde til antigenerne i bunden af brønden. Herefter vaskes overskydende antistof væk, og der tilsættes nu et andet antistof, der kan binde sig til det antistof, man tester for – dette kaldes et sekundært antistof. Igen vaskes det overskydende antistof væk. Det sekundære antistof er bundet til et enzym, og når man tilsætter et substrat, som kan omdannes af dette enzym, skifter opløsningen farve. Jo mere farveskift, desto mere enzym og antistof.
Denne test kan også vendes om til et direkte ELISA. I denne metode bruger man antistoffer fæstnet til brøndens bund til at undersøge for et formodet molekyle, se figur 16. Disse antistoffer er specifikke for et antigen på det molekyle, som man ønsker at teste for – fx et hormon eller et lægemiddel. Prøven man vil undersøge for pågældende antigen tilsættes, og hvis den indeholder antigen, vil det bindes til antistofferne. Der vaskes, og der tilsættes et antistof med samme antigen-specificitet, men som også er bundet til et enzym. Tilsætningen efterfølges af en vask, så kun de antistoffer, der er bundet til antigenet forbliver. Ved tilsætning af substrat vil der fremkomme en farvereaktion, som skyldes, at enzymet omdanner substratet til et farvet produkt. Jo mere farvereaktion, desto mere enzym og antigen.
Et western blot er en teknik, der gør det muligt at teste for tilstedeværelsen af et specifikt protein i en opløsning med mange forskellige proteiner. Teknikken bruges ofte til at teste for antistoffer ved diagnosticering af patienter. Behandler man et protein med et denaturerende stof, vil proteinet få en mere lineær form. Denne effekt udnyttes i western blot, hvor et denaturerende stof tilsættes den opløsning, der skal testes.
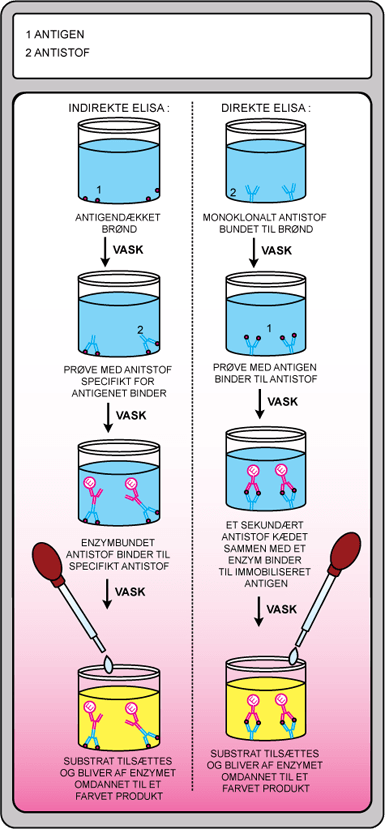
Figur 16. Illustrationen viser ELISA-metoden, hvor en prøve kan undersøges for tilstedeværelsen af antigen eller antistof.
Herefter påsættes de denaturerede proteiner en gele indeholdende det denaturerende stof, og der tilsluttes en spændingskilde. Da proteinet har en ladning, vil det bevæge sig i gelen. Små proteiner vil bevæge sig hurtigst. Denne forskel i hastighed vil resultere i, at proteinerne bliver adskilt efter størrelse. Metoden kaldes gelelektroforese. Efter at have bevæget sig ned ad gelen overføres proteinerne ved hjælp af en elektrisk strøm til en nylonmembran. Den negative pol placeres på gel-siden og den positive pol placeres på nylonmembran-siden. Herved vil de negativt ladede proteiner bevæge sig over på nylonmembranen og her befinde sig i samme mønster som på gelen.
Nylonmembranen dyppes i en opløsning, der indeholder antistoffer mod et ønsket antigen. Til sidst tilsættes et sekundært antistof, der binder til det første antistof. Dette sekundære antistof er bundet til et enzym, der udvikler en farve, når dets substrat også tilsættes. Herved kan tilstedeværelsen at et bestemt antigen eller protein visualiseres.
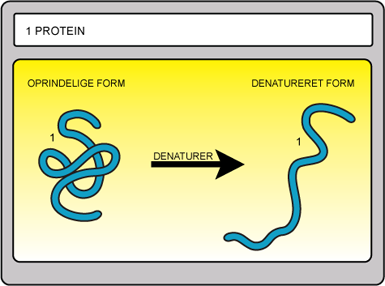
Figur 17. Når et protein denatureres, foldes det ud og bliver mere lineært.
Herefter påsættes de denaturerede proteiner en gele indeholdende det denaturerende stof, og der tilsluttes en spændingskilde. Da proteinet har en ladning, vil det bevæge dig i gelen.Små proteiner vil bevæge sig hurtigst. Denne forskel i hastighed vil resultere i, at proteinerne bliver adskilt efter størrelse. Metoden kaldes gelelektroforese. Efter at have bevæget sig ned ad gelen overføres proteinerne ved hjælp af en elektrisk strøm til en nylonmembran. Den negative pol placeres på gel-siden og den positive pol placeres på nylonmembran-siden. Herved vil de negativt ladede proteiner bevæge sig over på nylonmembranen og her befinde sig i samme mønster som på gelen.
Nylonmembranen dyppes i en opløsning, der indeholder antistoffer mod et ønsket antigen. Til sidst tilsættes et sekundært antistof, der binder til det første antistof. Dette sekundære antistof er bundet til et enzym, der udvikler en farve, når dets substrat også tilsættes. Herved kan tilstedeværelsen at et bestemt antigen eller protein visualiseres.
Denne metode anvendes bl.a. til at teste personer for HIV. Proteiner fra HIV-inficerede celler separeres i gel-elektroforesen og overføres til nylonmembranen. Her tilsættes serum fra en blodprøve taget fra den person, der skal testes for HIV. Såfremt personen har HIV, vil der findes anti-HIV-antistoffer i prøven, og disse vil bindes til proteinerne på nylonmembranen. Tilstedeværelsen af anti-HIV-antistoffer påvises ved at tilsætte sekundære antistoffer, koblet sammen med et enzym, mod humane antistoffer, og ved tilsætning af substrat vil der ske en farvereaktion, såfremt der var anti-HIV-antistoffer i prøven. Metoden der anvendes, er i princippet den samme som i to andre tests, Southern blot og Northern blot, hvor der henholdsvis testes for DNA og RNA.
Flowcytometri gør det muligt at teste for flere forskellige celletypers tilstedeværelse i en prøve, samt at sortere cellerne efter de forskellige typer. Denne metode anvendes fx til at teste blodets celler for kræftceller, der ofte giver en uforholdsmæssig forøgelse af enkelte celletyper. Flowcytometeret er i forbindelse med en computer, hvortil data sendes om antallet af de forskellige celletyper opsamles.
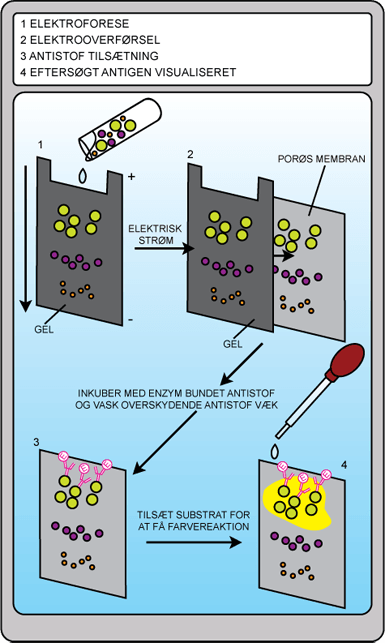
Figur 18. Figuren viser, hvordan man i western blotting kan vise tilstedeværelsen af forskellige proteiner i en prøve.
For at teste en prøve i et flowcytometer er det nødvendigt først at behandle prøven med antistoffer mod de antigener, der identificerer overflademarkører på de forskellige celler. Disse antistoffer er specielle, idet de er fluorescerende ved forskellige bølgelængder. Man kan således skelne imellem antistofferne og dermed imellem celletyperne. Prøven, der oftest vil være en blodprøve, suges ind i flowcytometeret. Det sker langsomt, så kun en enkelt celle ad gangen kommer ind i cytometeret. Nu sendes en laserstråle mod cellen, hvilket exciterer det fluorescerende antistof. Dette resulterer i udsendelsen af fotoner, der har forskellige egenskaber afhængigt af, hvilke stoffer der er brugt til at lave de fluorescerende antistoffer.
Resultatet er, at der udsendes lys ved forskellige bølgelængder, afhængigt af hvilken celle der passerer igennem flowcytometeret, og maskinen kan herved skelne imellem celletyperne. Når cellerne har passeret igennem flowcytometeret, kan de sorteres og opsamles hver for sig, således at man kan lave videre undersøgelser på nogle af cellerne.
Denne metode anvendes bl.a. når man skal producere antistoffer, og derfor ønsker at isolere de antistofproducerende celler.
Udfældning bygger på princippet om, at tunge molekyler kan fælde ud i en opløsning. Udfældning af antigener kan finde sted ved tilsætning af den rette mængde antistoffer.
Antistofferne har to bindingssteder, og vil på den måde krydsbinde flere antigener. Der dannes herved et stort net af krydsbundede antigener og antistoffer. Dette vil på et tidspunkt nå en sådan størrelse, at det udfældes (se figur 19).
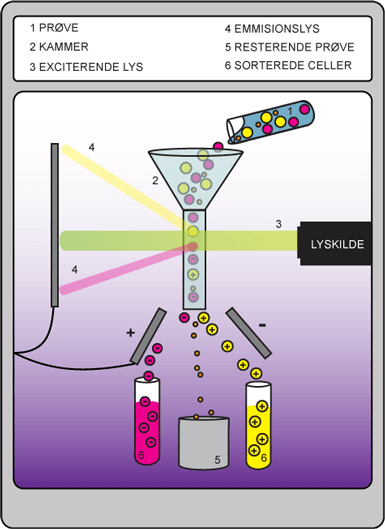
Figur 19. Figuren viser, hvordan celler kan analyseres i et flowcytometer. Her bliver cellerne sorteret efter type.
Dette fungerer bedst med polyklonale antistoffer da de vil have flere bindingssteder på det ønskede molekyle.
For at udfældning sker optimalt, er det vigtigt, at hverken koncentrationen af antistof eller antigen er for stor. Er der for meget antistof til stede, vil manglen på frie bindingssteder gøre, at hvert antistof kun binder til ét molekyle. Der vil derfor ikke kunne krydsbindes imellem de enkelte molekyler, og udfældning vil ikke finde sted. Ligeledes, hvis der er for meget antigen til stede, vil der være for få antistoffer til at kæde molekylerne sammen, se figur 20.
Der er yderligere lavet en udvikling af denne metode kaldt dobbelt immundiffusion, hvor både antistof og antigener tilsættes to brønde ved siden af hinanden og diffunderer mod hinanden. Der, hvor diffusionen resulterer i ækvivalens af både antigen og antistof, vil der formes en linje mellem de to brønde, som kan visualiseres med farvestof.
I begge tilfælde kræves det, at man har en standardprøve, således at man kan relatere diameteren af cirklen i immundiffusion og linjen i dobbelt immundiffusion til en bestemt koncentration af antistof. Standardprøven laves ved at lade kendte koncentrationer af antigen (eller antistof der kan bindes til de anvendte antistoffer) diffundere i gelen og tegne en graf over de målte diametre.
Du kan læse om blodets AB0-system ved at klikke her http://www.netbiologen.dk/immum/abo.html
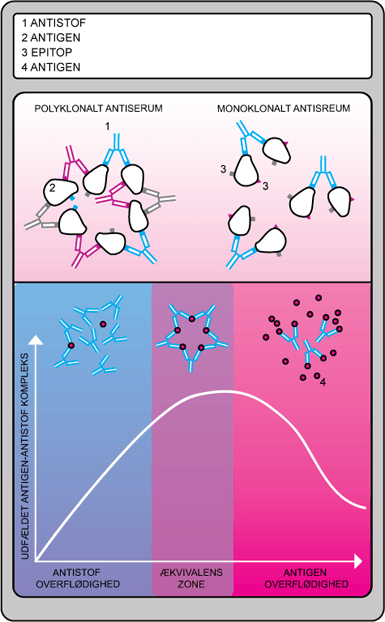
Figur 20. Figuren viser princippet i udfældningsreaktioner, hvor kun en passende mængde antigen og antistof vil give en høj udfældning.
Immundiffusion benytter princippet om udfældning af store antigen-antistof-komplekser. I denne metode anvendes dog ikke flydende medier, men antistoffer inkorporeret i eksempelvis agar i en petriskål. I midten af skålen laves et hul, hvor agaren udtages, og i dette hul kan en farvet opløsning af antigen tilsættes. Antigenet vil nu diffundere ud i gelen og bindes til antistofferne.
Der, hvor antigenerne er diffunderet ud, og koncentrationen er i antigen-antistof-ækvivalenszonen, vil store antigen-antistof-komplekser formes. Det vil kunne ses som en farvet ring omkring det hul, hvor antistoffet er tilsat. Denne ring er i figur 21 kaldt P.
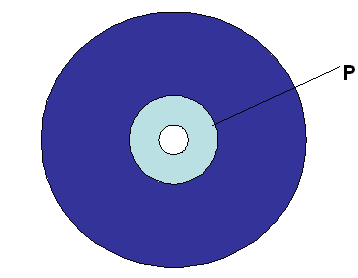
Figur 21. Figuren viser et immundiffusion-forsøg, hvor antigen er tilsat en brønd i midten. Antigenet vil diffundere ud i gelen, som indeholder antistof. Størrelsen af zonen (vist ved P) giver et indtryk af, hvor meget antigen, der var til stede i prøven.
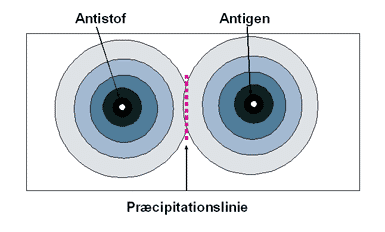
Figur 22. Figuren viser princippet i dobbelt immundiffusion, hvor antigen og antistof diffunderer mod hinanden i en gel.