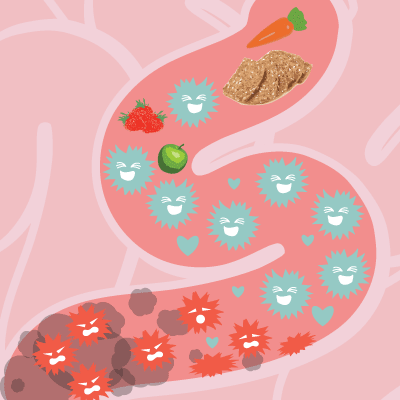
Når man behandler med antibiotika, især bredspektret antibiotika, risikerer man, at de gavnlige bakterier også slås ihjel, hvilket skaber ubalance i mave-tarm-kanalen. Denne ubalance betyder, at de skadelige bakterier får bedre overlevelsesmuligheder, og dermed øges risikoen for bakterieinfektioner i tarmen.
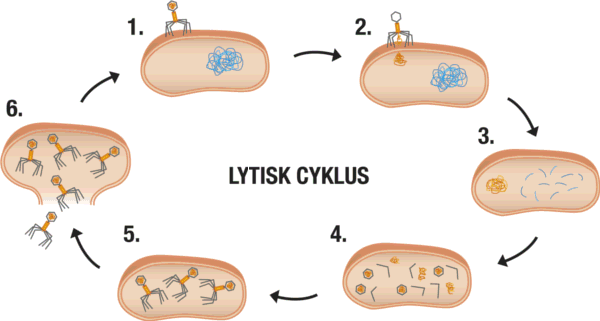
En anden fordel ved bakteriofager er, at de på kort tid mangedobler sig selv på infektionsstedet i kroppen. Når bakteriofagen angriber en vært og gennemgår den lytiske cyklus, vil nydannede bakteriofager frigives på infektionsstedet (se punkt 6 i figur 13) og angribe nærliggende bakterieceller. Så længe der er værter til stede, dvs. bakterier som bakteriofagen kan angribe, vil frigivne bakteriofager kunne gennemgå den lytiske cyklus og dræbe alle de andre bakterier. Når alle værter er slået ihjel, vil bakteriofagerne ikke længere kunne formere sig, og herefter kan kroppen udskille de resterende bakteriofager vha. immunforsvaret og nyrerne. I kontrast til dette, vil antibiotika ikke nødvendigvis samle sig omkring infektionsstedet, da det løbende vil blive nedbrudt af leveren og udskilt fra kroppen via urinen. Derfor vil længerevarende antibiotikabehandlinger ofte være nødvendige, før alle skadelige bakterier er uskadeliggjort, og risikoen for resistens øges derfor markant.
Bakteriofagresistens
Bakterier kan udvikle resistens over for bakteriofager, ligesom de kan udvikle resistens over for antibiotika.
I den forbindelse er det en fordel, at bakteriofagerne har en meget høj specificitet. Bakterier kan være modtagelige over for mange typer af bakteriofager på en gang, og da der i naturen findes en meget bred variation af bakteriofagarter, vil udvikling af resistens ikke have de store konsekvenser. Faktisk er bakteriofager den mikroorganisme med højest biodiversitet, dvs. at der findes forskellige arter overalt i naturen. Alene i jorden findes omkring 100 mio. (100.000.000) bakteriofager pr. gram jord. Grundet den høje biodiversitet af bakteriofager synes det derfor nemmere at overkomme bakteriofagresistens, da man “bare” kan behandle med en anden type af bakteriofager, hvis der opstår resistens. Det synes usandsynligt at en bakterie vil være resistent overfor alle bakteriofager på en gang.
I dag bruger man endnu ikke bakteriofagterapi til behandling af bakterieinfektioner, da effekten ikke er videnskabelig anerkendt og gennemtestet. Der er stadig lang vej, førend bakteriofagterapi vil være et alternativ til antibiotika. Interessen for forskning i emnet er øget de seneste år i takt med, at anvendelsen af store mængder antibiotika har skabt resistensproblemer. Derfor er der håb om, at bakteriofagterapi i fremtiden vil komplementere antibiotikabehandling til bakterieinfektioner og derved sikre, at effekten af de eksisterende antibiotika kan opretholdes over længere tid.
Vigtigt at huske:
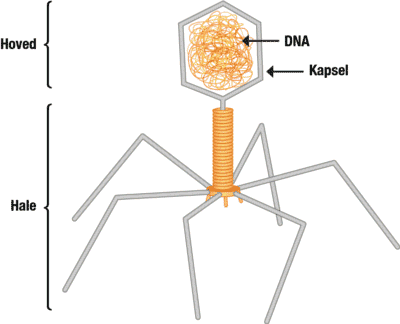
- Bakteriofager er en type af virus, der formerer sig selv ved at trænge ind i bakterier og slå dem ihjel.
- Bakteriofagterapi forsøger at udnytte bakteriofagernes bakteriedræbende egenskaber til at bekæmpe infektionssygdomme forårsaget af bakterier.
- Fordelene ved bakteriofagterapi er, at bakteriofager mangedobler sig på infektionsstedet, samt at de har en høj specificitet, sådan at de gavnlige bakterier i tarmen ikke slås ihjel.
- Ulempen ved bakteriofagterapi er, at de bekæmpes af kroppens immunforsvar, idet de kategoriseres som fremmede organismer, hvis de kommer i kontakt med blodet
- Bakterier kan blive resistente over for bakteriofager, ligesom det er tilfældet med antibiotika. Bakteriofagresistens synes dog nemmere at overkomme, fordi de er meget specificerede, samt at biodiversiteten af bakteriofagarter er meget stor.
- Bakteriofagterapi er endnu ikke videnskabeligt anerkendt og gennemtestet og anvendes derfor ikke i praksis endnu.