Mikromorfologiske kendetegn
Hvis I vil se på svampene under mikroskop, følger her en liste over sporernes udseende på de enkelte svampe.
Conidia:
Cylindriske og rundede ender: 12, 19a, 19b
Elliptiske: 1, (3a), (3b), 4, (5b), (5c), (6a), 7, 8, 9, 10, 12, 14a, 14b, 16a, 16b, 17a, 17b, 19a, 19b, (20),21, 22, 25, 26, 27
Echinulate: 3d, 13a, 13b
Let ru: 4, 18d, (20), 22,
> 3.5 µm long: 12, 19a, 19b, 26, 27
Phialides:
< 6.5 µm long: 17a, 17b
Kort med bred tyk hals: 6a, 6b, 6c, 21
Rami:
Divergent: 2, 6a, 6b, 6c, (8), (12), 17a, (18d), 21,
Højt antal: 22
Få eller ikke til stede: 12, 26, 27
Supplerende koloni-kendetegn for Penicillium
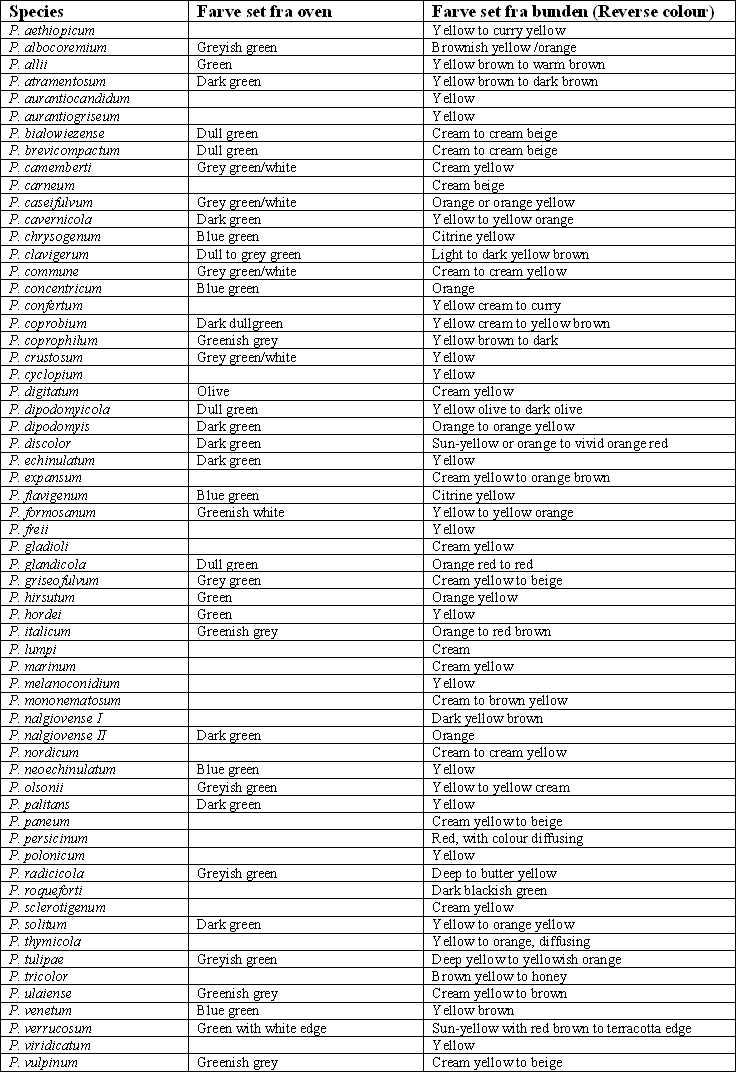
P. aethiopicum: Stærkt pliceret revers på CYA og YES. Gult revers på CYA. Stængler typisk ru på MEA, men glatte på CYA.
P. albocoremium: Hvide synnemata på MEA. Vatagtig koloni på CYA.
P. allii: Korte meget ru stængler. Flade kolonier.
P. atramentosum: Rødbrunt revers på CYA.
P. aurantiogriseum: Tydeligt blå (grønne) konidier på MEA. Ofte grålige og ellipsoide konidier på CYA.
P. aurantiovirens: Flokkøs på MEA, vattet mycelie-rand, mange exudat-dråber, blå (grønne) konidier på MEA.
P. brevicompactum: Penicilli kompakte, opsvulmede for enden af stængel og metulae. Phialiderne spredt ud som en vifte, ligner overfladisk ligner en Aspergillus.
P. camemberti: Hvide vattede kolonier på alle substrater.
P. carneum: Flødefarvet til lysebrunt revers på CYA. Kan gro på 0.5 % edddikesyre. Gror godt på nitrit agar. Lugter kraftigt af ‘mug’.
P. chrysogenum: Ofte gule exudatdråber og revers på CYA. Tynde kolonier på MEA. Næsten altid store kolonier på alle substrater.
P. clavigerum: Nåleformede indeterminate synnemata. Brungult revers CYA.
P. commune: Oftest svag sporulation YES. Flødefarvet revers, der bliver brunt til sortbrunt med tiden på YES i mange, dog ikke alle isolater.
P. concentricum: Blågrønne konidier på MEA, orange revers på MEA. Af og til tændstikformede synnemata på MEA.
P. coprobium: Mørkegrønne konidier på CYA. Af og til små hvide sclerotier på MEA. Konidier i koncentriske ringe på CYA.
P. coprophilum: Mørkebrunt revers CYA. Meget ujævn kolonimargen på især MEA.
P. crustosum: Konidier dannes i så stort tal at der efter 7-14 dage dannes skorper.
P. cyclopium: (grå)grøn på CYA, men blå grå grøn på MEA, stærkt gult obvers og flad koloni på YES.
P. digitatum: Konidier (olivenfarvede) er usædvanligt store og af varieret form og størrelse. Penicilli er ofte fragmentariske med kun to delepunkter.
P. discolor: Meget mørkegrønne konidier på alle substrater, revers på YES bliver orange til kraftig rødt efter 7-14 dage.
P. echinulatum: Meget mørkegrønne konidier på alle substrater.
P. expansum: Ret “høje” kolonier, lidt vatagtige. Ofte klare eller brune exudatdråber på CYA. Brunligt revers på CYA. Af og til synnemata (tændstikformede) på MEA.
P. freii: Store klare exudat-dråber på CYA, særlig stærk sporeproduktion på CYA.
P. glandicola: Rødorange revers på MEA, fjeragtige synnemata på MEA.
P. griseofulvum: Meget små phialider (< 6.5 mm) med korte halse.
P. hirsutum: Gulbrunt revers og exudatdråber på CYA. Ofte gule tændstikformede synnemata på MEA.
P. hordei: Vatagtig på CYA med gult mycelium. Gule synnemata (fjeragtige) på MEA.
P. italicum: Brunrødt revers på CYA. (P. ulaiense forekommer på citrus frugter,den vokser langsomt på CYA, har flødefarvet revers og tydelige hvide synnemata)
P. melanoconidium: Mørkegrønne konidier på CYA, men blågr¢nne konidier på MEA. Gult revers på CYA.
P. nalgiovense: Orange revers på MEA. Hvide eller lyst grågrønne konidier. Konidier kan dog også være mørkt grønne. Indtil videre kun fundet på salami.
P. nordicum: Flødefarvet revers på YES. Langsomtvoksende på CYA og MEA. Rent grønne konidier.
P. olsonii: Meget lange stilke med multiramulate penicilli. Ligner overfladisk en Aspergillus i stereomikroskop.
P. palitans: Stærk sporulation på YES, grønne konidier. Gul til gulorange revers. Mørkegrønne konidier på CYA.
P. paneum: Hurtigtvoksende på alle substrater. Flødefarvet til lysebrunt revers på CYA. Kan gro på 0.5 % edddikesyre. Gror godt på nitrit agar.
P. polonicum: Stor flad koloni på CYA med blågrønne konidier
P. roqueforti: Kan gro på 0.5 % edddikesyre. Gror godt på nitrit agar. Mørkegrønt revers på CYA. Spindelvævsagtig tynd kolonimargin på CYA og MEA.
P. sclerotigenum: Sclerotier på MEA. Hidtil kun fundet på yams.
P. solitum: Mørkegrønne konidier på CYA. Flødefarvet revers på CYA ofte med brun midte.
P. venetum: Stærktfarvet brun + bananfarvet revers på CYA, blågrønne konidier. Ret lav væksthastighed.
P. verrucosum: Gullig til flødefarvet revers på CYA, kraftig rødbrunt til violetbrunt revers på YES. Langsomtvoksende på CYA og MEA. Rent grønne konidier.
P. viridicatum: Rent grønne konidier på alle substrater.
P. vulpinum: Store tændstikformede synnemata på CYA og MEA.
Sekundære metabolitter og TLC
Produktionen af sekundære metabolitter detekteret ved TLC
Herunder ser I en liste over sekundære metabolitter, og de svampe der producerer dem.
3-methoxyviridicatin: 3b, 3d, 3f, 3g, 3i, 18b, 18c, 18e
Aurantiamine: 3a, 3f, 3d
Brevianamide A: 3e, (4)
Chaetoglobosin C: 14a, 13b
Chrysogine: 6a, 6b, 6c, 18b
Citrinin: 14a, 18b, 24b
Compactin A & B: 18a, (20)
Cyclopaldic acids: (5a), 5b, 21, (23b)
Cyclopenin & Cyclopenol: 3b, 3d, 3f, 3g, 3i, (5c), 11, 13a,13b,18b, 18c, 18e, 20, 25
Cyclopiazonic acid: 5a, 5b, 5c, (7), 17a, 17b
Griseofulvin: 1, 9, 17a, 17b, 26
Isofumigaclavine A: 5c, 7, 23a, 23b
Meleagrin: (2), 6a, 8, 9, 10, 16a, 16b, 18b, 18c, (25)
Met O: 4, 22
Mycophenolic acid: 4, (23a), 23b
Ochratoxin A: 24a, 24b
Oxaline: 2, 3c, 9, 16a, 25, 27
Penicillic acid: 3a, 3b, 3c, 3d, (3e), (3f), 3g, 3i, 18b,(23b)
Penitrem A: 3c, 7, 11, 16a, (16b), 18b, 23b
Raistrick phenols: 4
Roquefortine C: (2), 6a, (7), 8, 9, (10), 11, 14a, 16a, 16b,17a,18a, 18b, 18c, 18e, 23a, 23b, 23c, 25, 26, (27)
Rugulovasine A & B: 2, (5a), 5b
Terrestric acid: 3a, 3h, 11, 18a, 18b, 18d, 18e
Territrems: 13a
Verrucosidin: 3a, 3b, 3c
Viomellein: (3c), 3e, 3f, 3h, 3i, (7)
Viridamine: 3e
Viridicatin: (5c), 11, 13a, 13b, 20, 25
Xanthomegnin: (3c), 3e, 3f, 3h, 3i, (7)
Metabolitnøgle for Penicillium metabolitter
Denne tabel viser Rf værdierne for en række forskellige metabolitter, når der benyttes hhv. TEF og CAP som løbevæske ved TLC’en. Herudover forklares plettens farve på TLC pladen under forskellige behandlinger.
|
Metabolit
|
Rf værdi: TEF/CAP
|
Før spray
|
AlCl3
|
Ce(SO)4
|
ANIS
|
|
3-methoxyviridicatin
|
154 / 88
|
blå
|
blå
|
blå
|
blå
|
|
Aurantiamin
|
31 / 80
|
blå
|
blå
|
grå
|
grå
|
|
Brevianamide A
|
71 / 86
|
gul-grøn
|
gul
|
orangeVIS
|
grå-gul
|
|
Chaetoglobosin C
|
111 / 80
|
mørk
|
mørk
|
mørk
|
brun
|
|
ChrysoginY
|
62 / 28
|
blå254
|
blå
|
grå
|
grå
|
|
CitrininY
|
126H / 15H
|
gul-grøn
|
gul
|
gul
|
lys gul
|
|
Compactin A & BY
|
54+94 / 54+104
|
DI
|
DI
|
DI
|
gul-brun
|
|
Cyclopaldic acidsY
|
77+146 / 54
|
svag blå254
|
turkis
|
turkis
|
lys turkis
|
|
Cyclopenin
|
111 / 94
|
DI
|
violetVIS
|
grå
|
grå
|
|
Cyclopenol
|
82 / 79
|
DI
|
grå-blåVIS
|
grå
|
grå
|
|
Cyclopiazonic acid
|
130H / 17H
|
brun
|
blå-brun
|
lys
|
lys brun
|
|
Griseofulvin
|
100 / 100
|
blå
|
grå
|
grå
|
lys blå
|
|
(Iso)fumigaclavine A
|
7 / 33
|
grå
|
grå
|
grå
|
brun
|
|
Meleagrin/Oxaline
|
4 / 74
|
DI
|
brun-gulVIS+365
|
|
Met O
|
120 / 125
|
gul-grøn254
|
gul
|
gul
|
gul
|
|
Mycophenolic acid
|
135 / 85
|
blå254
|
blå
|
blå
|
blå
|
|
Ochratoxin A
|
153 / 23
|
blå-grøn
|
blå-grøn
|
blå-grøn
|
blå-grøn
|
|
Penicillic acidY
|
103 / DI
|
DI
|
DI
|
DI
|
rød-blå
|
|
Penitrem A
|
189 / 120
|
DI
|
blå-sortVIS+365
|
|
Raistrick phenols
|
87/35
|
blå254
|
blå
|
blå
|
blå
|
|
Roquefortine C
|
0 / 46
|
DI
|
DI
|
orangeVIS
|
mørkVIS
|
|
Rugulovasine A & B
|
11 / 22+50
|
grå-blå
|
grå-blå
|
grå
|
grå
|
|
Terrestric acidY
|
106H / 100
|
DI
|
DI
|
DI
|
gulVIS
|
|
Territrems
|
85+115+140 /
112+96+85
|
blå
|
blå
|
blå
|
blå
|
|
Verrucosidin
|
144 / DI
|
DI
|
DI
|
DI
|
brun-gul
|
|
Viomellein
|
106 / 104
|
gul-brunVIS
|
gul-brunVIS
|
DI
|
mørk
|
|
Viridamine
|
20 / 46
|
lys blå
|
blå
|
blå
|
blå
|
|
Viridicatin
|
154 / 77H
|
svag blå254
|
violet
|
grå-blå
|
grå-blå
|
|
Xanthomegnin
|
74 / 80
|
gul-brunVIS
|
gul-brunVIS
|
DI
|
mørk
|
Y Metabolitterne dannes bedst på YES; H Metabolitterne ses ikke som veldefinerede pletter, men som haler.; DI Detekteres ikke under de givne betingelser; 365 Farven ses under UV lys 365 nm; 254 Farven ses under UV lys 254 nm; VIS Farven ses ved synligt lys.
Kendte Penicillium metabolitter detekteret via TLC
Denne oversigt beskriver hvilke metabolitter de enkelte Penicillium stammer producerer. Den kan også benyttes til at identificere svampe med.
P. aethiopicum: Griseofulvin
P. albocoremium: Citrinin, (penicillic acid), meleagrin, roquefortine C, terrestric acid, viridicatins, penitrem A
P. allii: meleagrin, Roquefortine C, viridicatin
P. atramentosum: (Meleagrin), oxaline, (roquefortine C), rugulovasine
P. aurantiogriseum: Aurantiamine, penicillic acid, terrestric acid, verrucosidin
P. aurantiovirens: 3-methoxyviridicatins, penicillic acid
P. brevicompactum: Brevianamide, mycophenolic acid, met. O, raistrick phenols
P. camemberti: Cyclopiazonic acid
P. carneum: Isofumigaclavin A, (cyclopaldic acid), mycophenolic acid, (penicillic acid), penitrem A, roquefortine C,
P. chrysogenum: Roquefortine C, chrysogine, meleagrin
P. clavigerum: (Meleagrin), penitrem A, (roquefortine C), (viomellein)
P. commune: Cyclopaldic acid, cyclopiazonic acid, rugulovasine
P. concentricum: Meleagrin, (penitrem A), roquefortine C
P. coprobium: Patulin, (roquefortine C), (meleagrin)
P. coprophilum: Griseofulvin, meleagrin, oxaline, roquefortine C
P. crustosum: Penitrem A, roquefortine C, terrestric acid, viridicatins
P. cyclopium: 3-methoxyviridicatins, penicillic acid, xanthomegnin, viomellein
P. discolor: Chaetoglobosins, viridicatins
P. echinulatum: Territrems, viridicatins
P. expansum: Roquefortine C, chaetoglobosins, citrinin
P. freii: Aurantiamine, xanthomegnin, viomellein, 3-methoxyviridicatins
P. glandicola: Meleagrin, oxaline, penitrem A, roquefortine C
P. griseofulvum: Cyclopiazonic acid, fulvic acids, griseofulvin, roquefortine C
P. hirsutum: Compactins, roquefortine C, terrestric acid
P. hordei: Roquefortine C, terrestric acid, (viridicatins)
P. melanoconidium: Oxaline, penicillic acid, penitrem A, verrucosidin, (viomellein), (xanthomegnin)
P. nalgiovense: (Chrysogine)
P. nordicum: Ochratoxin A, verrucolone
P. olsonii: Met. O
P. palitans: Cyclopiazonic acid, (viridicatins), isofumigaclavine A,
P. paneum: Roquefortine C
P. polonicum: Penicillic acid, verrucosidin, 3-methoxyviridicatins
P. roqueforti: (Mycophenolic acid), isofumigaclavin A, roquefortine C
P. sclerotigenum: Griseofulvin, roquefortine C
P. solitum: Compactins, viridicatins
P. venetum: Roquefortine C, terrestric acid, viridicatins
P. verrucosum: Ochratoxin A, citrinin, verrucolone
P. viridicatum: Brevianamide A, viomellein, viridamine, xanthomegnin
P. vulpinum: Meleagrin, oxaline, roquefortine C, viridicatins