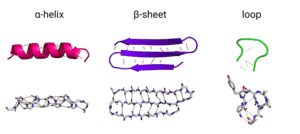
Der er 3 forskellige sekundære strukturer; α-helixer, β-sheets og β-loops. Dette er lokale strukturer i proteinet dannet af bindinger mellem peptider, der ligger tæt på hinanden i polypeptidkæden. Hovedkæden af polypeptidet er polær, da peptidbindingen indeholder en hydrogendonor, NH, og en carbonylgruppe (C=O), som er i stand til at danne hydrogenbindinger. Denne polaritet er et problem hvis der skal skabes et hydrofobt miljø, og for at overkomme dette problem bliver α helixer og β sheets dannet. Deres dannelse neutraliserer nemlig polariteten ved at der bliver dannet hydrogenbindinger mellem NH og C=O grupperne i peptidbindingerne.
I α-helixer danner carbonylgruppen en hydrogenbinding med H fra peptidbindingen, der er fire aminosyreenheder længere nede i kæden. Der dannes herved en højredrejende helix, med 3.6 peptider pr. sving. I enderne af α-helixer er der en C=O og NH-gruppe der ikke danner bindinger. De er derfor stadig polærer og man ser derfor typisk enderne af helixer nær overfladen af proteinet. Disse helixer er typisk 4 til over 40 peptider lange i globulære proteiner.
I β-sheets dannes der også hydrogenbindinger mellem NH og C=O grupperne i peptidbindingerne, men mellem kæder der ligger parallelt langs hinanden. β-sheets danner derfor en flad struktur, hvor de parallelle kæder typisk er 5-10 aminosyreenheder lange.
α-helixer og β-sheets er forbundet med β-loops, som typisk ligger på overfladen af proteinet. Dette er fordi, der ikke dannes hydrogenbindinger mellem NH og C=O i β-loops. Aminosyrerne er frit tilgængelige til at danne hydrogenbindinger i det miljø proteinet befinder sig i.
Ladninger af aminosyrer på overfladen af proteinet afgør også, hvordan proteiner interagerer med andre biomolekyler i dets miljø. F.eks. har nukleaser, der er i stand til at bryde phosphordiesterbindingerne i bl.a. DNA, flere positivt ladet aminosyrer på dets overflade og derfor interagerer det nemmere med det negativt ladet DNA.
« Back to Glossary Index
