Virologi: Læren om virus
Resume: I projektet ‘ Virologi: Læren om virus’ undersøger vi, hvordan en virus er opbygget. Vi vil kigge nærmere på evolutionære <br>aspekter, udseende og livscyklussen af en virus.
Vira (flertal af virus) har eksisteret lige så længe, der har eksisteret cellulært liv på jorden – måske endda før, og de vil sandsynligvis blive ved med at eksistere, så længe der findes liv, som de kan udnytte til deres reproduktion. Diversiteten blandt vira er enorm, og deres måde at leve på er lige så. En virus er en fascinerende pseudoorganisme, som på trods af dens mikroskopiske størrelse og simple udformning kan overtage selv de mest avancerede cellulære organismer. Alligevel er de flestes viden om vira begrænset til dem, som kan skade os enten fysisk eller økonomisk.
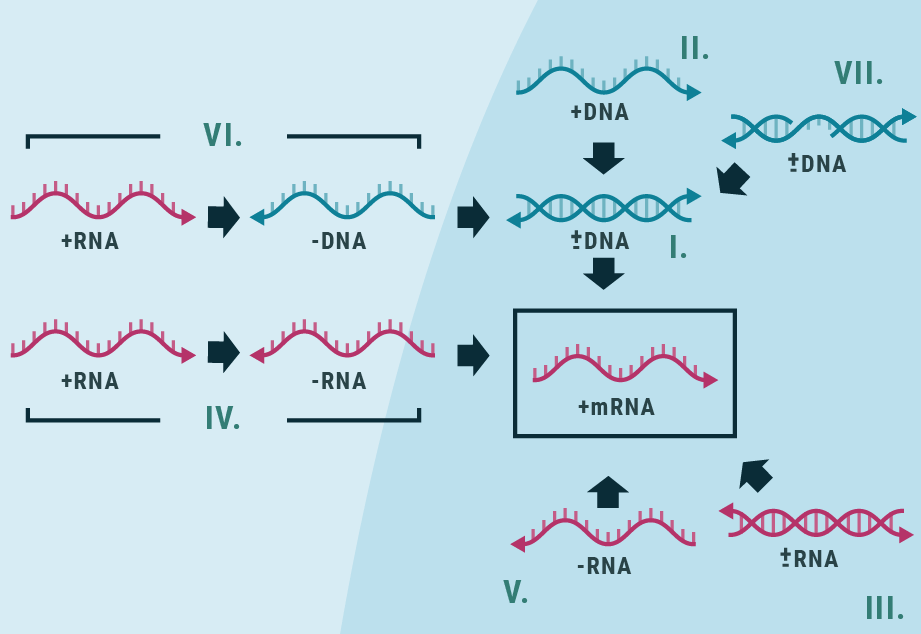
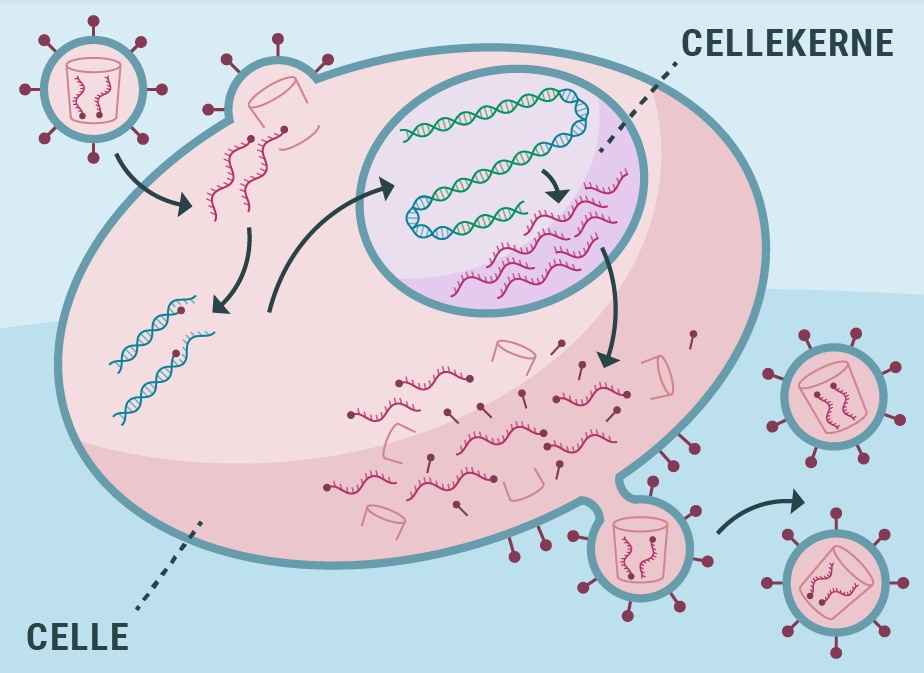
Det vil dette undervisningsmateriale forsøge at ændre på. Gennem artiklerne vil viden om vira udvides: deres morfologi, genetiske diversitet og livscyklus. Vira er obligate intracellulære parasitter, som er afhængige af en vært for reproduktion. Læren om den virale livscyklus er dermed også læren om værten og dens cellulære processer.
Formålet med dette undervisningsmateriale er ligeledes også at give et mere nuanceret billede af vira. Der findesvira, som kan skade os både fysisk og økonomisk, men der findes også viras om slet ikke gør os noget. Der findes sågar også vira, som vi kan udnytte til vores egen fordel f.eks. inden for sygdomsbekæmpelse.
Vira er nogle af naturens mest effektive jægere, som i de sidste par årtier har fået udvidet deres jagtmarker. Den øgede globalisering af verden, har medført, at antallet af mulige værter, som en enkelt virus kan komme i kontakt med, er blevet betydelig forøget. Dette faktum kan medføre, at lokale epidemier hurtigt kan forvandles til verdensomspændende pandemier. Undervisningsmaterialet vil præsentere konsekvenserne af en viral epidemi og løsningen til at forhindre at en lokal epidemi spreder sig og bliver til en pandemi.