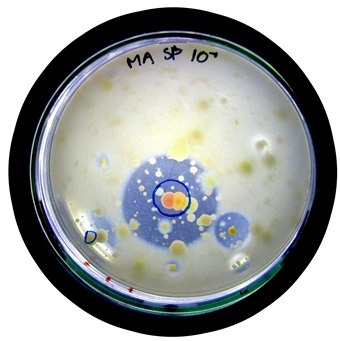
Figur 1. Klaringszoner rundt om de bakteriekolonier, der danner protease-enzymer.
Enzymer, der er aktive under kolde forhold, har adskillige bioteknologiske anvendelsesmuligheder. Nye smarte og bæredygtige produkter kan nemlig blive udviklet på baggrund af netop kuldeaktive enzymer. Det gælder for eksempel vaskepulver, der kan vaske tøjet rent ved brug af ikke-opvarmet vand. Snavs på tøjet består blandt andet af sukkerstoffer, fedt og proteiner. En af de typer enzymer, som man ofte anvender i vaskepulver, er derfor protease, der nedbryder proteiner. I dette forsøg skal I selv finde bakterier, der producerer kuldeaktive protease-enzymer, og som i teorien vil kunne bruges til produktion af et mere miljørigtigt vaskepulver. Det gør I ved at samle tangplanter fra vandet ved en kyst eller en sø. På tangen lever der et væld af bakterier, som har tilpasset sig det kølige miljø i vandet, og det vil derfor være sandsynligt at nogle af disse bakterier netop producerer kuldeaktive protease-enzymer. Tangplanterne blendes med vand, og blandingen bliver spredt ud på agarplader, sådan at bakterierne kan vokse frem her. Agarpladerne tilsættes skummetmælkspulver, fordi det indeholder proteiner, som protease-enzymerne kan nedbryde. Hvis nogle af de bakteriekolonier, som vokser frem på agarpladerne, danner protease, vil proteinet i skummetmælkspulveret blive nedbrudt i en cirkel rundt om kolonien. Det kan ses som en såkaldt klaringszone, altså en cirkel hvor agaren er blevet gennemsigtig i stedet for grumset hvid. Det kan se ud som på figur 1. Man kan på den måde tydeligt se, hvilke bakterier, der kan være af særlig interesse, hvis man skal lave miljøvenligt vaskepulver.
Forsøget kan med fordel laves i små grupper på 3-4 elever.
Fremstilling af agarplader
Materialer og udstyr
Hver gruppe skal bruge fem agarplader i forsøget. Mængden af plader, der fremstilles, kan tilpasses, så det passer med antallet af grupper. Til ca. 40 agarplader skal der bruges følgende:
- 15 g agarpulver. Det kan med fordel være ”Marine Agar 2216”, som kan bestilles hos Difco (cat. no. 212185), men man kan også sagtens bruge almindeligt agar, som ikke er tilsat næringsstoffer eller salte. Det kan blandt andet købes hos Frederiksen.
- 1 L vand. Brug helst destilleret vand, men almindeligt postevand vil også kunne bruges.
- 20 g skummetmælkspulver. Det kan fås i de fleste supermarkeder.
- 20 g NaCl. Almindeligt køkkensalt kan sagtens bruges. Hvis tangplanterne er indsamlet i en sø, tilsæt da kun 10 g NaCl. NaCl skal helt udelades, hvis man bruger ”Marine Agar 2216”.
- Gryde med låg til kogning af agarblandingen.
- Gasblus eller kogeplade.
- Piskeris til omrøring.
- Ske til at fjerne klumper og skum.
- Ca. 40 stk. petriskåle.
- Plastposer til opbevaring af de færdige agarplader.
- Vægt.
- 1 L måleglas.
Fremgangsmåde
Denne del af forsøget kan læreren eventuelt lave forud for undervisningen. Agarpladerne kan sagtens laves nogle dage i forvejen, hvis de blot opbevares med bunden opad i plastposer i et køleskab, indtil de skal bruges.
- Afvej agar, skummetmælkspulver og eventuelt salt, og bland det med 1 L destilleret vand i en gryde.
- Før der tændes for varmen, røres klumperne forsigtigt ud. Brug gerne en ske til at fjerne de sidste små klumper ved at mase dem op ad grydens side.
- Opvarm forsigtigt blandingen på et gasblus eller en kogeplade. Det er vigtigt, at der røres relativt forsigtigt så skumdannelsen mindskes mest muligt. Dog skal der en næsten konstant omrøring til, for at blandingen ikke brænder fast i bunden. Når agaren er smeltet, og blandingen er ensartet, skrues der op for varmen, så blandingen lige kommer op at koge. Hold hele tiden øje med gryden, for det koger let over. Lad den ikke koge i mere end et par minutter, da der ellers fordamper for meget vand fra gryden. Det er dog vigtigt, at blandingen kommer op og koge, så de fleste mikroorganismer dør. For at gøre processen så enkel som muligt autoklaveres pladerne nemlig ikke. Det er derfor samtidigt vigtigt at være omhyggelig med ikke at udsætte agarblandingen for unødig kontakt med omgivelserne.
- Sluk for varmen, og fjern med en ske det meste af skummet, der er dannet på overfladen af blandingen. Det er godt at få så meget af skummet med som muligt, fordi man på den måde mindsker mængden af luftbobler i de færdige agarplader.
- Lad eventuelt agarblandingen køle lidt af under låg, hvis den stadig er kogende – men lad den ikke køle for længe, for så begynder agaren at blive tyktflydende.
- Fordel agarblandingen i petriskåle, så det dækker bunden, og tykkelsen af agarlaget er omkring en halv centimeter. Der burde være til omkring 40 stykker. Pas på ikke at brænde dig på den varme agar.
- Lad pladerne stivne i omkring 15 min. med lågene sat skråt på, så der er en lille sprække åben. På den måde minimeres mængden af kondens.
- Opbevar de færdige plader med låg på og bunden opad i plastposer i køleskabet.
- Tag dem ud i stuetemperatur ca. en time før brug, så de lettere optager blandingen af vand og tang. Lad dem eventuelt tørre i en LAF-bænk med lågene halvt på.
Indsamling og dyrkning af bakterier
Materialer og udstyr
- Plastpose eller beholder med låg til indsamling af tangplanter.
- Frisk tang indsamlet i havet eller en sø. Der skal kun bruges en lille smule, så en håndfuld er rigeligt til alle grupperne.
- Lidt vand fra indsamlingsstedet – fyld posen eller boksen med tangplanterne med hav- eller søvand. Der skal teoretisk set bruges mindre end 100 mL i alt, men det er fint at have noget i overskud.
- Fem agarplader med skummetmælkspulver til hver gruppe (lavet i forvejen ud fra forskriften ovenfor).
- Blender, foodprocessor eller lignende.
- Pipette (100 µL til 1000 µL) til hver gruppe.
- Fem eppendorfrør, reagensglas eller falkonrør til hver gruppe.
- Tre kaffefiltre til filtrering.
- Tragt til filtrering.
- Bægerglas eller lignende til den filtrerede tangblanding.
- Ethanol.
- Lille bægerglas til hver gruppe til ethanol.
- Bunsenbrænder til hver gruppe.
- Køleskab.
- Sprittusser til at skrive på petriskålene.
- Drigalskispatel til hver gruppe til udpladning på agarpladerne.
Fremgangsmåde
Indsamling af tangplanter
- Indsaml tangplanter fra vandet ved en kyst eller en søbred, og opbevar dem i en plastpose eller boks fyldt med vand fra indsamlingsområdet. Ved længere tids opbevaring, eksempelvis natten over, skal tangplanterne i køleskabet. Det er ikke selve tangplanten, vi er interesseret i, men snarere de mange bakterier, der lever på dem. Disse bakterier lever nemlig i et relativt koldt miljø, og man kan derfor forestille sig, at de producerer enzymer, der er virksomme ved temperaturer lavere end de 30 °C til 40 °C, som vi normalt vasker tøj ved.
- Dette, samt næste trin, kan med fordel gøres samlet for hele klassen. Blend en lille tot af tangplanterne og lidt af det tilhørende vand, så det bliver til en så ensartet blanding som muligt. Det vil dog ofte være umuligt at få blandingen helt ensartet. Blandingen skal imidlertid være tynd og finblendet nok til at kunne passere igennem et kaffefilter. Der skal gerne være så meget vand i forhold til tang, at det bliver meget tyndtflydende. Der skal bruges under 10 mL tangblanding i alt, men blend gerne et større volumen, så det er nemmere at arbejde med. Brug dog ikke alt hav- eller søvandet, for der skal være minimum 50 mL tilbage i alt til de fortyndingsrækker, grupperne laver senere.
- Filtrer de tilbageblevne tangstykker fra ved at lade blandingen passere gennem tre kaffefiltre, som er sat oven i hinanden i en tragt. Opsaml den filtrerede væske i et rent bægerglas.
- Hver gruppe får et eppendorfrør med 1 mL filtreret tangblanding. Herpå skrives 100 med en sprittus. Denne notation betyder, at tangblandingen ikke er fortyndet, da 100 = 1.
- I grupperne laves der en fortyndingsrække ud fra den ufortyndede tangblanding, altså ud fra 100-røret.

Figur 2. Fremgangsmåde for at lave en fortyndingsrække af den filtrerede tangblanding.
Det gøres på følgende måde: Klargør fire rør og skriv 101, 102, 103 og 104 på dem med sprittus. I 101-røret vil tangblandingen blive 101 =10 gange fortyndet, i 102-røret vil blandingen blive 102 = 10∙10 = 100 gange fortyndet, i 103-røret vil det være 103 = 10∙10∙10 = 1000 gange fortyndet og i 104-røret vil den oprindelige tangblanding blive 104 = 10∙10∙10∙10 = 10.000 gange fortyndet. Selve fortyndingen laves ved at starte med at komme 0,9 mL = 900 µL hav- eller søvand i hvert af de fire rør (101, 102, 103 og 104) med en pipette. Der overføres nu 0,1 mL = 100 µL af tangblandingen fra 100-røret til 101-røret, og der blandes grundigt ved at røre rundt med pipettespidsen. Derefter tages 0,1 mL = 100 µL fra 101-røret og overføres til 102-røret, og der blandes igen. På samme måde overføres 0,1 mL = 100 µL fra 102-røret til 103-røret, og efter en grundig omrøring overføres der fra 103-røret til 104-røret. For hver overførsel mellem rørene fortyndes der altså 10 gange. Jo mere man fortynder, desto færre bakterier er der til stede. Husk at skifte pipettespids mellem hver overførsel. Fremgangsmåden kan desuden ses i figur 2.
- Gør fem agarplader klar. Skriv fortyndingerne 100 til 104 og gruppenavn eller -nummer på bunden af petriskålene. Skriv aldrig på lågene, da de ved en fejl kan komme til at blive byttet rundt.
- Hæld en smule ethanol op i et lille bægerglas, find en drigalskispatel frem, og tænd bunsenbrænderen.
- Kom omkring 100 µL af 100– fortyndingen ud på den tilhørende agarplade. Det svarer nogenlunde til en stor dråbe.
- Dyp drigalskispatelen ned i ethanol, og hold den meget kort ind i flammen fra bunsenbrænderen for at antænde ethanolen. Dette sikrer, at der ikke sidder uønskede bakterier på spatelen.
- Lad spatelen køle ned i ca. 10 sekunder uden at den rører ved noget.
- Fordel væsken rundt på agarpladen med drigalskispatelen. Bliv ved med at stryge spatelen rundt, til agaren har optaget al tangblandingen, og den derfor føles tør, når man bevæger spatelen rundt. Læg låg på pladen, så snart den er færdig.
- Gentag trin 8-11 for de andre fortyndinger.
- De fem petriskåle med tangblandingerne stables med bunden opad og kommes i en plastpose. Det er meget vigtigt at petriskålene vendes sådan, at bunden med agaren er opad. Hvis der dannes kondens inde i petriskålen, vil det nemlig løbe ned i låget i stedet for at havne på agaren og ødelægge bakteriekolonierne, som vokser her.
- Stil pladerne ved stuetemperatur. Det anbefales dog, at det er et køligt sted, hvor temperaturen ikke pludselig stiger, fordi solen for eksempel står direkte ind på.Den efterfølgende uge
- For at pladerne ikke bliver overgroet af bakterier, og klaringszonerne derfor ikke ses tydeligt, er det en god idé at kigge til agarpladerne hver dag. Det vil dog sandsynligvis tage fire til syv dage, før der har været en tilstrækkelig bakterievækst, så mange tydelige kolonier og – forhåbentlig – klaringszoner kan ses. Når dette stadie nås, sættes pladerne i køleskabet, for at bremse væksten indtil de skal undersøges.Observationsdag
- Kig på jeres fem agarplader. Er der nogle af bakteriekolonierne, som har dannet protease-enzymer, og som man derfor kunne se nærmere på ved fremstilling af miljøvenligt vaskepulver?
Diskussionsspørgsmål til forsøget
Ud fra afsnittet om psykrofile bakterier i teoridelen vil I så tro, at de bakterier, som vokser frem på agarpladerne, kan kategoriseres som psykrofile eller psykrotolerante bakterier?
I dette forsøg har det været formålet at undersøge, om nogle af bakterierne fra de indsamlede tangplanter producerer protease-enzymer. Tror I, at det kun er bakterier fra tangplanterne, som I ser på agarpladerne? Hvis ikke, hvor kunne de øvrige bakterier på pladerne så komme fra?
Diskuter spørgsmålene to og to eller i mindre grupper, og skriv jeres svar ned. Husk en begrundelse.