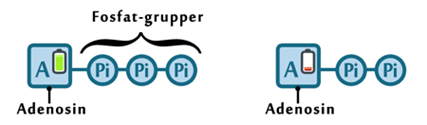
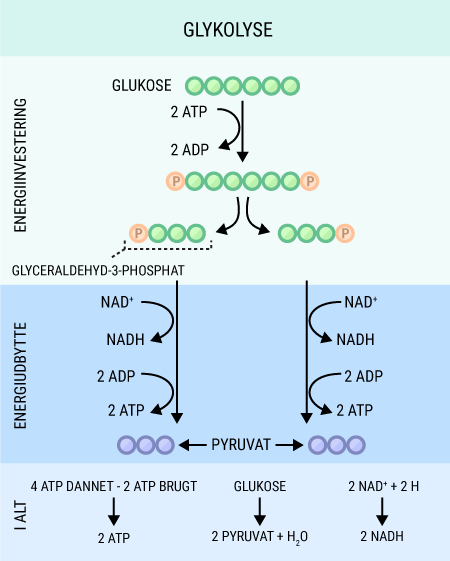
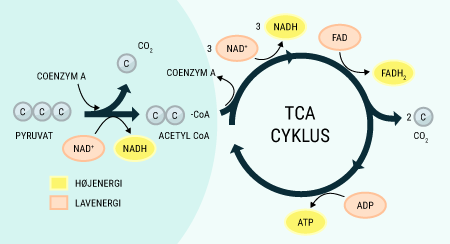
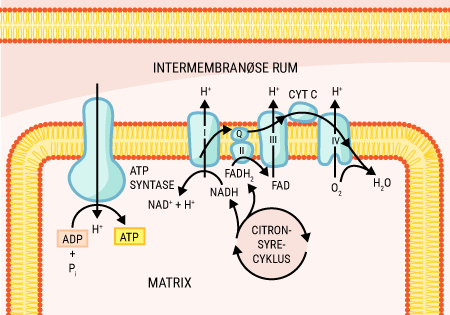
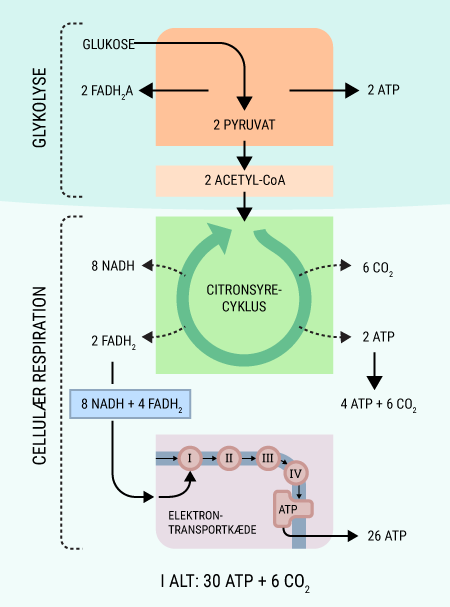
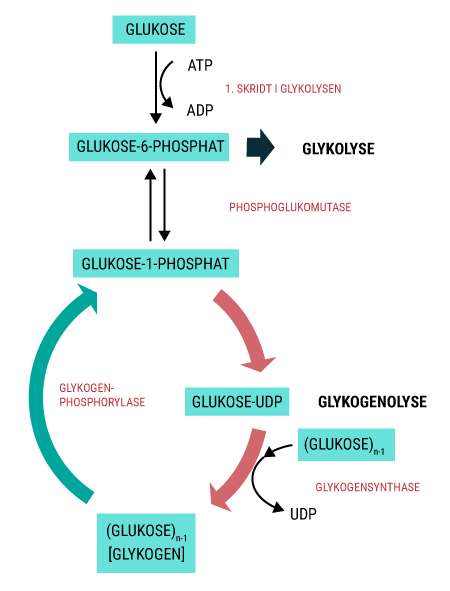
Alt liv afhænger af energi. Menneskekroppen er ingen undtagelse. Mens planter får den nødvendige energi til deres fotosyntese fra solen, er vi mennesker nødt til at indtage energiholdig føde for at drive de kemiske processer, der hele tiden foregår i vore kroppe. Glukose er den bedste kilde til kemisk energi, som mennesket har. Alle celler kan optage glukose, der findes i det meste af den føde, vi indtager. Glukose er et monosakkarid, hvilket er den simpleste slags kulhydrat, som kan optages og direkte bruges af kroppen. Imidlertid indtager vi ofte glukose i større molekyler, såkaldte polysakkarider, som kroppen ikke kan anvende, før de er blevet nedbrudt til monosakkarider. I sidste ende kan monosakkariderne igennem en række processer blive til ATP (adenosin triphosfat), som er molekyler med energiholdige phosphatbindinger. Disse kan enten lagres, til de skal bruges, eller brændes af med det samme, hvorved de kan drive en lang række kemiske processer i kroppen.
Energiomsætningen kan groft sagt reduceres til et spørgsmål om ”kalorier ind og kalorier ud”. Næringsstofferne har forskelligt indhold af energi, og fordelingen fremgår herunder:
| ENERGIVÆRDI AF FORSKELLIGE NÆRINGSSTOFFER |
| Næringsstof |
Kalorieværdi
(kcal/g) ved
menneskelig
forbrænding |
Jouleværdi
(kJ/g) ved
menneskelig
forbrænding |
Anvendt værdi
ved beregning,
hhv. kcal/g og kJ/g. |
Dagligt behov
i gram,
(gns. 8.700 kJ) |
| Protein |
4,2 |
17,6 |
4 kcal/g |
17 kJ/g |
50 g |
| Kulhydrat |
4,1 |
17,2 |
4 kcal/g |
17 kJ/g |
310 g |
| Fedt |
9,3 |
39 |
9 kcal/g |
37 kJ/g |
70 g |
| Alkohol |
7,1 |
29,7 |
7 kcal/g |
29 kJ/g |
0 g |
| Fiber |
3 |
12,56 |
3 kcal/g |
3 kJ/g |
30 g |
| Vand |
0 |
0 |
0 kcal/g |
0 kJ/g |
2-3.000 g |
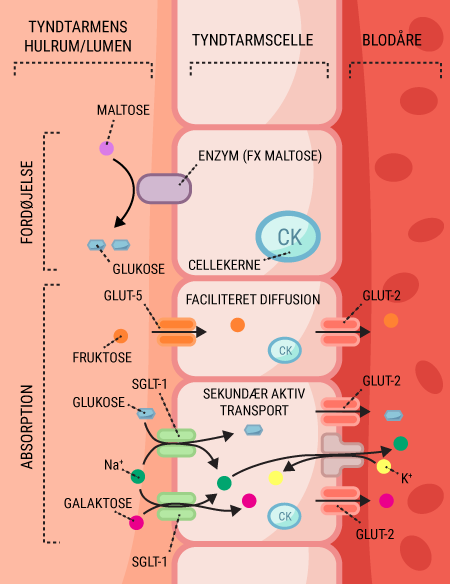
For at udvinde energien af et næringsstof, skal det først fordøjes og nedbrydes til mindre bestanddele. I det følgende gennemgås denne proces for kulhydrat, da det dels er det bedste energisubstrat, dels det næringsstof, vi indtager mest af i det hele taget. Desuden er det reguleringen af blodsukkerniveauet, der bliver påvirket, når man udvikler diabetes.