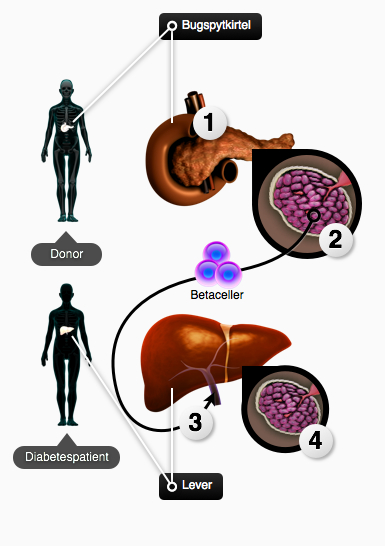
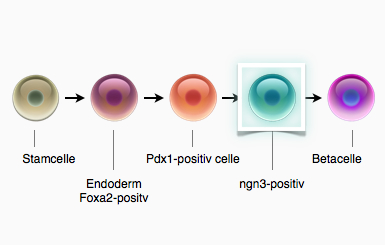
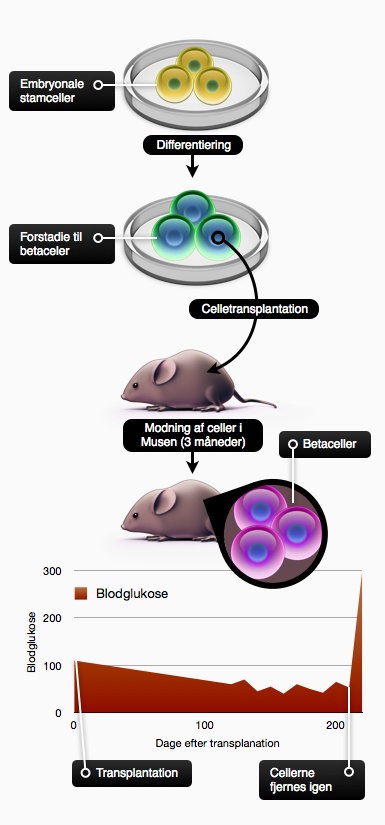
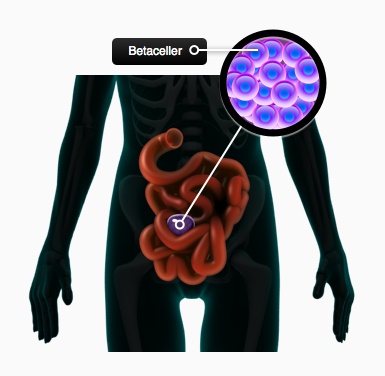
Perspektiver for stamcelleterapi
Stamcelleterapi af sygdomme
Her præsenteres nogle af de mest lovende anvendelser af stamcelleterapi til behandling af sygdomme. Fælles for de fleste af sygdommene er, at patienten efter noget tid vil afstøde de transplanterede celler. Forskning i metoder til at skabe tolerance i patienten (som beskrevet i foregående artikel), er derfor særdeles relevant. En levende pacemaker
En pacemaker virker ved løbende at sende elektriske impulser ind i hjertet, da dette har mistet evnen til selv at igangsætte sammentrækningerne. Ved rene tilfældigheder har forskere observeret, at stamcellekulturer pludselig differentierer sig til hjerteceller, der banker i en petriskål. Derfor er det planen, at disse celler skal transplanteres, og det er håbet, at de kan sørge for at hjertet slår, uden at patienten behøver en elektrisk pacemaker.
Leukæmi – kræft i de knoglemarvsstamceller, der danner blodceller
Det er voksne stamceller i knoglemarven, der laver alle blodceller. Blodceller har en kort levetid, hvorefter de udskiftes af nye blodceller lavet i knoglemarven. Ved at udskifte den kræftramte knoglemarv med en ny lavet fra stamceller, er forskere i stand til at helbrede leukæmi – alle de nydannede blodceller vil være normale.
Blodpropper undgås
I dag forebygges og helbredes blodpropper, ved at indoperere et lille gitter, der udvider den ramte blodåre. Gitteret er dækket med kemikalier, der medfører, at kroppens immunforsvar først nedbryder gitteret efter længere tid. Men ved i stedet at dække gitteret med voksne stamceller fra patienten selv, er det forskernes håb, at de kan få kroppen til ikke at frastøde gitteret, så det kan blive der resten af patientens levetid.
Parkinsons og Alzheimers sygdom
Både Parkinsons og Alzheimers sygdom er sygdomme i hjernens nerveceller. Der forskes meget i at differentiere stamceller til nye nerveceller, som kan transplanteres og erstatte de syge eller døde nerveceller, der er årsagen til disse sygdomme.
Lamme går og blinde ser
Der er udført succesfulde forsøg på lamme mus, hvor nerveceller, lavet fra stamceller, transplanteres ind i rygmarven. Herved genvinder musene førligheden. Forskerne håber, at samme metode kan bruges på mennesker.
Det er også lykkedes forskere at lave bestemte øjenceller fra stamceller. Disse celler er herefter transplanteret ind i blinde rotter, hvorefter nogle af dem har genvundet synet. Næste skridt er også her at gøre behandlingen så sikker, at den kan prøves ved kliniske test på mennesker.
Stamceller som forskningsværktøj til udvikling af nye lægemidler
Et andet stort potentiale ved stamceller er muligheden for at anvende dem til at identificere og teste nye lægemidler. Stamcelleforskningen åbner op for produktion af ubegrænsede mængder af forskellige ‘raske og syge’ celletyper. Ved at teste forskellige stoffers effekt på sådanne celletyper, kan de anvendes som et værktøj til at screene for nye lægemidler. Samtidig vil cellekulturene kunne bruges til at teste effekt og sikkerhed i udviklingen af nye lægemidler, før de indledende kliniske forsøgsbehandlinger af mennesker sættes i gang.